题目内容
已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11.向0.1mol/L NaOH溶液中通入CO2,若溶液的pH=10(不考虑溶液的体积变化),则下列说法正确的是( )
| A、2c(CO32-)+c(HCO3-)=0.1mol/L | ||||
B、
| ||||
| C、该溶液中加BaCl2溶液,溶液pH增大 | ||||
| D、在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.
=
=
;
C.该溶液中加入氯化钡溶液,发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,溶液中的溶质部分由碳酸钠转化为NaCl;
D.
=
=
=
=0.47,则c(CO32- )<c(HCO3-),溶液中不存在NaOH,该溶液为缓冲溶液,加水稀释溶液pH变化不明显.
B.
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
C.该溶液中加入氯化钡溶液,发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,溶液中的溶质部分由碳酸钠转化为NaCl;
D.
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
| 4.7×10-11 |
| 10-10 |
解答:
解:
=
=
=
=0.47,则c(CO32- )<c(HCO3-),溶液中不存在NaOH,溶质为碳酸钠和碳酸氢钠,该溶液为缓冲溶液,
A.根据电荷守恒得2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),溶液呈碱性,则c(OH-)>c(H+),所以2c(CO32-)+c(HCO3-)<c(Na+)=0.1mol/L,故A错误;
B.
=
=
=
=0.47,故B正确;
C.该溶液中加入氯化钡溶液,发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,溶液中的溶质部分由碳酸钠转化为NaCl,溶液由碳酸钠弱碱性溶液转化为NaCl中性溶液,所以pH减小,故C错误;
D.该溶液为缓冲溶液,加水稀释时,促进盐类水解,但碳酸氢根离子和碳酸根离子相互抑制水解,所以其pH变化不明显,故D错误;
故选B.
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
| 4.7×10-11 |
| 10-10 |
A.根据电荷守恒得2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),溶液呈碱性,则c(OH-)>c(H+),所以2c(CO32-)+c(HCO3-)<c(Na+)=0.1mol/L,故A错误;
B.
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
| 4.7×10-11 |
| 10-10 |
C.该溶液中加入氯化钡溶液,发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,溶液中的溶质部分由碳酸钠转化为NaCl,溶液由碳酸钠弱碱性溶液转化为NaCl中性溶液,所以pH减小,故C错误;
D.该溶液为缓冲溶液,加水稀释时,促进盐类水解,但碳酸氢根离子和碳酸根离子相互抑制水解,所以其pH变化不明显,故D错误;
故选B.
点评:本题考查了盐类水解和弱电解质的电离,根据溶液的pH及弱电解质的电离平衡常数确定溶液中的溶质,再结合电荷守恒、物质间的反应等知识点来分析解答,易错选项是B,根据离子之间的关系确定电离平衡常数与溶液pH的关系,难度中等.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |
化学创造了生活,也在改变着我们的生活.下列与化学有关的说法正确的是( )
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,在空气中能产生丁达尔现象 |
| B、在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 |
| C、经过必要的化学变化能从海水中提取NaCl、Mg、Br2等物质 |
| D、大量燃烧化石燃料排放的废气中大量CO2、SO2,造成大气污染,从而使雨水的PH=5.6形成酸雨 |
 常温下,向100mL 0.01mol?L-1 MOH溶液中逐滴加入0.02mo1?L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lg(OH-).下列说法中,不正确的是( )
常温下,向100mL 0.01mol?L-1 MOH溶液中逐滴加入0.02mo1?L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lg(OH-).下列说法中,不正确的是( )| A、HA为一元弱酸 |
| B、MOH为一元强碱 |
| C、N点水的电离程度大于K点水的电离程度 |
| D、K点对应的溶液的pOH=10,则有c(HA)+c(H+)-c(OH-)=0.01mol?L-1 |
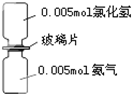 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |
下列叙述正确的是( )
| A、汽油、柴油和植物油都是烃 |
| B、油脂、淀粉和蛋白质均可发生水解反应 |
| C、乙烯和苯使溴水褪色都是发生加成反应 |
| D、苯环含有碳碳单键和碳碳双键 |
实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )
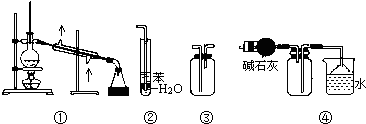
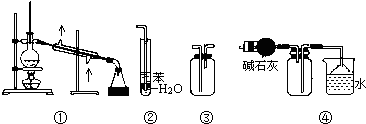
| A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C、装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
设NA代表阿伏加德罗常数的数值,下列说法中正确 的是( )
| A、将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| B、100mL 1mol?L-1 Na[Al(OH)4]溶液中含有0.1NA个[Al(OH)4]- |
| C、标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为NA |
| D、标准状况下,1.12L 1H2和0.2g 2H2均含有0.1NA个质子 |