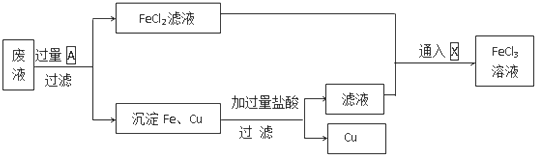
题目内容
11.有一块表面氧化成Na2O的金属钠样品,质量为5.4g,与适量水反应后得0.5mol/L的NaOH溶液400mL,求样品中金属钠和氧化钠的质量分别是多少?分析 设Na的物质的量为xmol、Na2O的物质的量为ymol,根据原子守恒知,生成的n(NaOH)=n(Na)+2n(Na2O)=0.5mol/L×0.4L=0.2mol,列方程组计算两种物质的物质的量,再根据m=nM计算两种物质的质量.
解答 解:设Na的物质的量为xmol、Na2O的物质的量为ymol,根据原子守恒知,生成的n(NaOH)=n(Na)+2n(Na2O)=0.5mol/L×0.4L=0.2mol,
则存在$\left\{\begin{array}{l}{23x+62y=5.4}\\{x+2y=0.2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.05}\end{array}\right.$
则m(Na)=0.1mol×23g/mol=2.3g,m(Na2O)=5.4g-2.3g=3.1g,
答:钠、氧化钠的质量分别为2.3g、3.1g.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,把握各个物理量之间的关系式是解本题关键,注意原子守恒的灵活运用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.用NA表示阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,32g03含有的氧原子数为2NA | |
| B. | 常温常压下,22.4LCH4含有的分子数为NA | |
| C. | 1Llmol•L-1CaCl2溶液中含有的Cl-数为NA | |
| D. | 1molZn变为Zn2+时失去的电子数为NA |
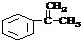
5.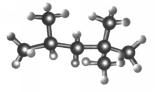 “辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
 “辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为( )| A. | 1,1,3,3-四甲基丁烷 | B. | 2,2,4-甲基庚烷 | ||
| C. | 2,4,4-三甲基戊烷 | D. | 2,2,4-三甲基戊烷 |
9.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是 2,5,5-三甲基-3-乙基庚烷 的名称是 2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将 与NaOH的醇溶液共热可制备 CH3-CH═CH2 与NaOH的醇溶液共热可制备 CH3-CH═CH2 | |
| C. | 向柠檬醛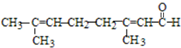 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
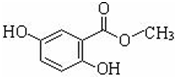 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
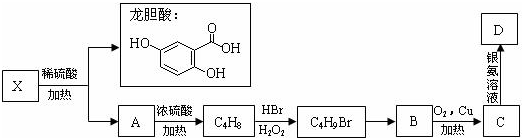
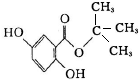

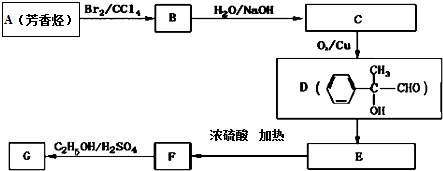
 .
.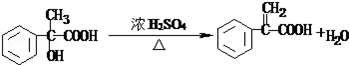 .
.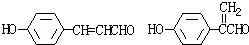 .
.