题目内容
20.某有机物11.0克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与26.4克,该有机物可能是( )| A. | CH4 | B. | C2H6 | C. | C6H6 | D. | C6H6O2 |
分析 完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与26.4克,可知n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,
n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,则有n(H)=0.6mol,m(H)=0.6g,n(C)=0.6mol,m(C)=0.6mol×12g/mol=7.2g,
结合质量守恒判断有机物中是否含有O元素,进而可计算该有机物的化学式.
解答 解:完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与26.4克,可知n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,
n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,则有n(H)=0.6mol,m(H)=0.6g,n(C)=0.6mol,m(C)=0.6mol×12g/mol=7.2g,
则0.6g+7.2g=7.8g<11.0g,所以一定含有O元素,且m(O)=11.0-7.8g=3.2g,n(O)=$\frac{3.2g}{16g/mol}$=0.2mol.
所以:n(C):n(H):n(O)=0.6mol:0.6mol:0.2mol=6:6:2,
故该有机物的化学式为C6H6O2,
故选D.
点评 本题考查有机分子式的计算,题目难度中等,本题注意根据水和二氧化碳的质量确定有机物是否含有O元素,计算出C、H、O的原子个数比可计算出该有机物的化学式.

练习册系列答案
相关题目
8. 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )| 序号 | 甲 | 乙 |
| A | 镁条 | 稀硫酸 |
| B | 硫酸铁溶液 | 氢氧化钠溶液 |
| C | 硝酸钡溶液 | 硫酸钠溶液 |
| D | 生锈的铁钉 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
15.宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O,其中H2S是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
11.1 摩尔甲烷完全和氯气发生取代反应,生成四种取代产物的物质的量相同,则 消耗氯气的物质的量为( )
| A. | 0.5 摩尔 | B. | 2 摩尔 | C. | 2.5 摩尔 | D. | 4 摩尔 |
 .
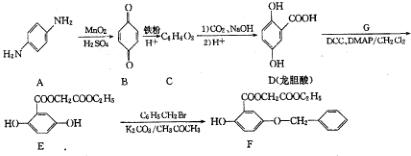
.
 ;
; ;
;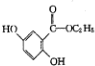 )的一种同分异构体的结构简式
)的一种同分异构体的结构简式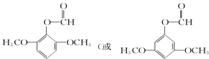 ;
;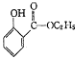 )的合成路线流程图(无机试剂任用),相关信息:
)的合成路线流程图(无机试剂任用),相关信息: .
.