题目内容
12.已知化学反应A2(g)+B2(g)=2AB(s)的能量变化如图所示,下列叙述正确的是( )
| A. | 该反应为放热反应 | B. | 加催化剂能降低该反应焓变 | ||
| C. | A-B的键能为bkJ•mol-1 | D. | 该反应的反应热为△H=(a-b)kJ•mol-1 |
分析 A、依据图象分析判断1molA2和1molB2反应生成2molAB,产物的能量高于反应物的能量;
B、催化剂只改变反应速率,不影响反应热大小;
C、A-B的键能为断裂1mol化学键吸收能量值;
D、反应热△H=反应物能量总和-生成物能量总和.
解答 解:A、依据图象分析判断1molA2和1molB2反应生成2molAB,产物的能量高于反应物的能量,为吸热反应,故A错误;
B、催化剂不影响反应热的大小,故B错误;
C、A-B的键能为0.5bkJ•mol-1,故C错误;
D、反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJ•mol-1,故D正确;
故选D.
点评 本题考查了化学反应的能量变化,图象分析判断,注意反应热△H=反应物能量总和-生成物能量总和,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中不正确的是( )
| A. | M为H2O | |
| B. | SnCl62-是氧化产物 | |
| C. | 还原性:As>SnCl2 | |
| D. | 每生成1molAs,反应中转移电子的物质的量为3mol |
3.巴黎气候大会揭开了发展低碳经济的宏伟序幕,下列有关说法正确的是( )


| A. | 太阳能、地热能、核能、化石燃料等均属于“新能源” | |
| B. | 减少含碳物质做燃料符合“低碳”理念 | |
| C. | 图中转化途径不能体现“节能减排”的思想 | |
| D. | 节约用电不能减少CO2的排放量 |
20.在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,甲烷的燃烧热是890.3kJ•mol-1,则下列热化学方程式书写正确的是( )
| A. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 |
7.某化学兴趣小组设计如下方案测定饱和食盐水的电解率.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率.

(1)正确的连接顺序为导管口B(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中铁棒(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
(3)部分实验过程如下:
①用碱式滴定管(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000mol•L-1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色时停止滴定;
③该小组所测实验数据如表:
未电解前饱和食盐水的物质的量浓度为5.4mol•L-1,经计算,求出该食盐水的电解率为7.4%.
④下列操作,会导致实验结果偏低的是AB(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率.

(1)正确的连接顺序为导管口B(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中铁棒(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
(3)部分实验过程如下:
①用碱式滴定管(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000mol•L-1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色时停止滴定;
③该小组所测实验数据如表:
| 实验序号 | 盐酸体积(mL) |
| 第一组 | 19.90 |
| 第二组 | 24.70 |
| 第三组 | 20.10 |
| 第四组 | 20.00 |
④下列操作,会导致实验结果偏低的是AB(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.
17.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示,下列说法正确的是( )大.

| A. | 放电时,正极质量增加 | |
| B. | 充电时,溶液中OH-移向碳电极 | |
| C. | 充电时,将电池的碳电极与外电源的负极相连 | |
| D. | 放电时,电路中每转移2mol电子,碳电极上有1molH2被还原 |
4.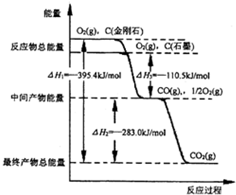 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)下列有关CO2说法不正确额是b(填字母)
a.CO2属于酸性氧化物
b.CO2是导致酸雨发生的主要原因
c.可用Na2CO3溶液捕捉(吸收)CO2
d.使用氢能源替代化石燃料可减少CO2排放
(2)金刚石和石墨燃烧反应中的能量变化如图所示.
①在通常情况下,金刚石和石墨中,石墨(填“金刚石”或“石墨”)更稳定.
②CO的燃烧热为283.0kJ•mol-1.
③石墨不完全燃烧生成CO的热化学方程式为C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体.
已知某些化学键能数据如下表:
已知CO中的键为C≡O,则工业制备甲醇的热化学方程式为CO(g)+2H2 (g)?CH3OH(g)△H=-116kJ/mol.
 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)下列有关CO2说法不正确额是b(填字母)
a.CO2属于酸性氧化物
b.CO2是导致酸雨发生的主要原因
c.可用Na2CO3溶液捕捉(吸收)CO2
d.使用氢能源替代化石燃料可减少CO2排放
(2)金刚石和石墨燃烧反应中的能量变化如图所示.
①在通常情况下,金刚石和石墨中,石墨(填“金刚石”或“石墨”)更稳定.
②CO的燃烧热为283.0kJ•mol-1.
③石墨不完全燃烧生成CO的热化学方程式为C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体.
已知某些化学键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
10.下列措施可使2HBr (g)?Br2 (g)+H2 (g)△H>0平衡向正反应方向移动的是( )
| A. | 升温 | B. | 加压 | ||
| C. | 恒温恒容通入氢气 | D. | 加入催化剂 |