题目内容
14. 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
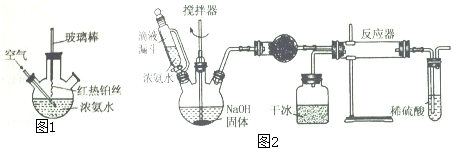
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:
①由图可知SCR技术中的氧化剂为NO、NO2
②用Fe做催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式2NH3+NO+NO2$\frac{\underline{\;Fe\;}}{△}$2N2+3H2O
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法.该法用Fe做电极电解含Cr2O32-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀.
①反应中lmolCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为12 mol.
②常温下,Cr(OH)3的溶度积Ksp=10-32,当Cr3+浓度小于10-5mol•L-1,时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后能(填“能”或“否,’)直接排放.
(3)C102气体是一种常用的消毒剂,现在被广泛的用于饮用水进行消毒.自来水厂用ClO2处理后的水中,要求C102的浓度在0.1-0.8mg•L-1之间.碘量法可以检测水中C102的浓度,步骤如下:
I.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加人一定量的碘化钾,并加人淀粉溶液,溶液变蓝;
Ⅱ.加人一定量的Na2S203溶液(已知:2S2O32-+I2═S4O52-+2I-);
Ⅲ.加硫酸调节水样pH至1.3.
已知:本题中C1O2在中性条件下还原产物为ClO2-,在酸性条件下还原产物为C1-.
请回答下列问题:
①确定操作Ⅱ完全反应的现象蓝色消失,半分钟内不变色
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式ClO2-+4I-+4H+=Cl-+2I2+2H2O
③若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol•L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是0.675mg•L-1.
分析 (1)①得电子,化合价降低的反应物是氧化剂;
②根据化合价升降总数相等、原子守恒来配平;
(2)①亚铁离子会和Cr2O72-的酸性废水反应,发生反应的离子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,结合电极方程式Fe-2e-═Fe2+计算;
②根据溶度积计算;
(3)①加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-;
②由图示表明,pH至1~3时,ClO2-将I-氧化生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
③根据关系式ClO2~I-~S2O32-先计算出ClO2的物质的量,然后再计算出浓度;
解答 解:(1)①由图甲可知SCR技术中NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2,故答案为:NO、NO2;
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,结合质量守恒可知方程式为:2NH3+NO+NO2$\frac{\underline{\;Fe\;}}{△}$2N2+3H2O,
故答案为:2NH3+NO+NO2$\frac{\underline{\;Fe\;}}{△}$2N2+3H2O;
(2)①亚铁离子会和Cr2O72-的酸性废水反应,发生反应的离子方程式是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,阳极电极方程式Fe-2e-═Fe2+,则
Cr2O72-~6Fe2+~12mol电子,1mol Cr2O72-完全生成Cr(0H)3沉淀,外电路通过电子的物质的量为12mol,
故答案为:12;
②溶液的pH=6,则c(OH-)=10-8mol•L-1,则c3(OH-)×c(Cr3+)=Ksp=10-32,c(Cr3+)=10-8mol•L-1<10-5mol•L-1,能直接排放,故答案为:能;
(3)①加入一定量 Na2S2O3 溶液,发生反应为:2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,故答案为:蓝色消失,半分钟内不变色;
②由图示表明,pH至1~3时,ClO2-将I-氧化生成的I2,ClO2-中氯的化合价由+3价降低到-1价,一个ClO2-得到4个电子,碘的化合价由-1价升高到0价,一个I-失去1个电子,转移电子的最小公倍数为4,结合质量守恒、电荷守恒可知离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
③ClO2 ~I-~S2O32-
1 1
1.0×10-5mol 1.0×10-3 mol/L×0.01L
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样的体积为1.0L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1,故答案为:0.675.
点评 本题主要考查了氧化还原反应、离子方程式式的书写以及化学计算,难度中等,注意掌握实验原理和电子得失配平的方法.

| A. | 0.12 mol | B. | 0.11 mol | C. | 0.09 mol | D. | 0.08 mol |
| A. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ•mol-1 | |||||||||||
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol
| |||||||||||
| C. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6 kJ/mol | |||||||||||
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| A. | PH>7的溶液中:K+、AlO2-、Cl-、SO42- | |
| B. | 含有0.1mol/L Fe3+的溶液中:K+、Mg2+、I-、SCN-、HCO3- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 在由水电离产生c(H+)=1×10-13mol/L的溶液中:Na+、S2O32-、Fe3+、NO3- |
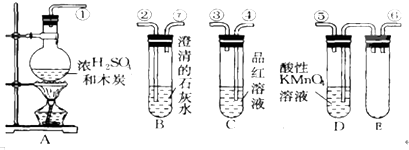
 我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:
我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题: