题目内容
6.根据下列实验装置图回答(装置用代号表示)
①实验室制氧气时,应选用的发生装置是A或者B;制氢气时应选用的发生装置是B,制二氧化碳时应选用的发生装置是B,检验二氧化碳气体可选用D装置,其装置中盛放的试剂一般是澄清石灰水.
②用锌粒和浓盐酸反应制氢气,将制成的气体通入硝酸银,有白色沉淀,说明氢气中含有(写化学式)HCl,反应的离子方程式为Cl-+Ag+═AgCl↓,若要制出纯净干燥的氢气,除发生装置外还应选用的一种装置是C;该装置中药品的作用是吸水和HCl气体.
分析 ①依据反应物状态和反应条件选择仪器,A适合固体+固体加热制备气体,B适合液体+固体(液体不加热)制备气体;二氧化碳能够使澄清石灰水变浑浊;
②浓盐酸易挥发,氯化氢能够与硝酸银反应生成氯化银沉淀;制出纯净干燥的氢气,应除去氢气中的氯化氢和水蒸气,固体氢氧化钠能够吸收氯化氢和水.
解答 解:①实验室制备氧气用高锰酸钾固体加热制备气体,选择A装置,或者用二氧化锰固体做催化剂,过氧化氢分解生成氧气,选择装置B;制氢气用锌与稀硫酸不加热,选择B装置;
二氧化碳能够使澄清石灰水变浑浊,检验二氧化碳气体可选用盛有澄清石灰水的D装置;
故答案为:A或者B;B;B 澄清石灰水;
②浓盐酸易挥发,氯化氢能够与硝酸银反应生成氯化银沉淀,离子方程式为:Cl-+Ag+═AgCl↓;固体氢氧化钠能够吸收氯化氢和水,可以除去氢气中的氯化氢和水蒸气,制出纯净干燥的氢气;
故答案为:HCl;Cl-+Ag+═AgCl↓;C;吸水和HCl气体.
点评 本题考查了常见气体的制备及除杂,熟悉装置特点,依据反应物状态和反应条件选择合适的发生装置是解题关键,题目难度不大.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案
相关题目
9.下列说法中正确的是( )
| A. | 氢键是一种较弱的化学键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 常温下,Cl2、Br2、I2的状态从气态、液态到固态,主要原因是分子间作用力在逐渐增大 | |
| D. | 最外层能达到稳定结构的微粒只是稀有气体的原子 |
17.向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.在一定条件下发生反应,各物质浓度随时间变化的情况如图甲所示.图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段为使用催化剂;图甲中t0~t1阶段c(B)未画出.
下列说法不正确的是( )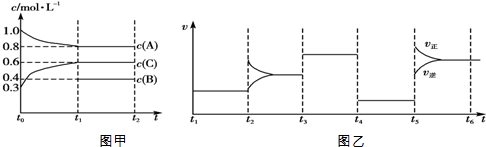
下列说法不正确的是( )

| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
1.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电.电池负极反应为( )
| A. | H2+2OH-=2H2O+2e- | B. | O2+4H++4e-=2H2O | ||
| C. | H2-2e-=2H+ | D. | O2+2H2O+4e-=4OH- |
11.某元素原子的原子核外有三个电子层,最外层上的电子数是另外两个电子层电子数之差,该原子核内质子数为( )
| A. | 18 | B. | 16 | C. | 8 | D. | 6 |
18.下列沸点比较正确的是( )
| A. | 正戊烷<异戊烷<新戊烷 | B. | 正戊烷>新戊烷>异戊烷 | ||
| C. | 邻二甲苯>间二甲苯>对二甲苯 | D. | 邻二甲苯<间二甲苯<对二甲苯 |
15.在短周期中的X和Y两种元素可组成化合物XY3,下列说法不正确的是( )
| A. | XY3可能是共价化合物 | |
| B. | 若Y的原子序数为m,则X的原子序数只能是m±4 | |
| C. | X和Y可在同一周期,也可在两个不同的周期? | |
| D. | X和Y可在同一周期,也可在同一主族 |
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.