题目内容
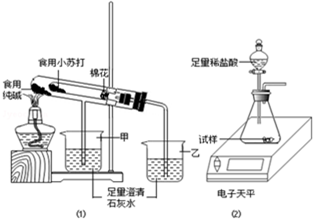 某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.【查阅资料】
| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变
(2)验证两种粉末的稳定性
在老师的指导下,该小组按如图1装置进行实验操作,观察到
(3)测定食用纯碱粉末的纯度
取食用纯碱粉末试样,利用如图2装置进行实验测定.数据记录如下:
| 称量项目 | 称量时间 | 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
②通过计算确定食用纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数.)
③如果测得的结果比实际纯度高,可能的原因是
考点:探究碳酸钠与碳酸氢钠的性质
专题:几种重要的金属及其化合物
分析:(1)根据表中数据判断碳酸钠、碳酸氢钠的酸碱性及强弱,测定溶液酸碱性可以用pH试纸完成;
(2)碳酸氢钠温度下小于碳酸钠,加热碳酸氢钠能够分解生成碳酸钠、二氧化碳和水,碳酸氢钠不分解,据此进行解答;棉花可以防止碳酸氢钠粉末进入导管;
(3)①根据表中数据判断反应前后质量差,结合反应方程式判断二氧化碳的质量及物质的量;
②根据碳酸钠与盐酸反应的化学方程式计算出碳酸钠的质量,然后计算出样品中碳酸钠的质量分数;
③测定结果偏高,说明测定的二氧化碳的质量偏大,据此进行判断.
(2)碳酸氢钠温度下小于碳酸钠,加热碳酸氢钠能够分解生成碳酸钠、二氧化碳和水,碳酸氢钠不分解,据此进行解答;棉花可以防止碳酸氢钠粉末进入导管;
(3)①根据表中数据判断反应前后质量差,结合反应方程式判断二氧化碳的质量及物质的量;
②根据碳酸钠与盐酸反应的化学方程式计算出碳酸钠的质量,然后计算出样品中碳酸钠的质量分数;
③测定结果偏高,说明测定的二氧化碳的质量偏大,据此进行判断.
解答:
解:(1)从表中可以看出食用纯碱和食用小苏打的水溶液均显碱性,遇酚酞均能变红,且碱性越强颜色越红,所以食用纯碱溶液碱性更强;测定溶液酸碱性强弱程度可直接用pH试纸或PH计测定,
故答案为:红;食用纯碱(或Na2CO3);pH试纸;
(2)由表中数据可知:食用小苏打可以加热分解生成二氧化碳,而食用纯碱不能,所以分析装置可知乙烧杯的澄清石灰水变浑浊,其分解方程式为:2NaHCO3
Na2CO3+CO2↑+H2O;碳酸氢钠粉末若加入导致,可能会导致导管被堵塞,装置中的棉花团可以防止加热时小苏打(或NaHCO3)粉末进入导管,
故答案为:乙; 2NaHCO3
Na2CO3+CO2↑+H2O;防止加热时小苏打(或NaHCO3)粉末进入导管;
(3)①由表中数据可知,11g样品与盐酸完全反应的质量变化是(11g+160g)-166.6g=4.4g,根据反应方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑可知,此质量差即为生成二氧化碳的质量.则生成二氧化碳的物质的量为:
=0.1mol,
故答案为:0.1;
②设生成4.4g二氧化碳时需要碳酸钠的质量是x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
=
,
x=
=10.6g,
所以食用纯碱粉末中Na2CO3的质量分数为:
×100%≈96.4%,
答:食用纯碱粉末中Na2CO3的质量分数96.4;
③通过以上计算可知如果测得的结果比实际纯度高,则测量的二氧化碳质量比实际值偏大,可能的原因为稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大,
故答案为:稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.
故答案为:红;食用纯碱(或Na2CO3);pH试纸;
(2)由表中数据可知:食用小苏打可以加热分解生成二氧化碳,而食用纯碱不能,所以分析装置可知乙烧杯的澄清石灰水变浑浊,其分解方程式为:2NaHCO3
| ||
故答案为:乙; 2NaHCO3
| ||
(3)①由表中数据可知,11g样品与盐酸完全反应的质量变化是(11g+160g)-166.6g=4.4g,根据反应方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑可知,此质量差即为生成二氧化碳的质量.则生成二氧化碳的物质的量为:
| 4.4g |
| 44g/mol |
故答案为:0.1;
②设生成4.4g二氧化碳时需要碳酸钠的质量是x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4 |
x=
| 106×4.4g |
| 44 |
所以食用纯碱粉末中Na2CO3的质量分数为:
| 10.6g |
| 11g |
答:食用纯碱粉末中Na2CO3的质量分数96.4;
③通过以上计算可知如果测得的结果比实际纯度高,则测量的二氧化碳质量比实际值偏大,可能的原因为稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大,
故答案为:稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.
点评:本题考查了碳酸钠、碳酸氢钠的性质,题目难度中等,此题是一道实验探究题,解题的关键是利用相关题目中的信息结合探究过程中有关的反应进行分析判断,题目难度中等,注重基础,能较好的训练和强化学生所学的基础知识.

练习册系列答案
相关题目
下列物质的分类结果正确的是( )
| A、焦炉气-混合物 胆矾-纯净物 臭氧-单质 |
| B、纯碱-碱 硫化氢-酸 小苏打-酸式盐 |
| C、油脂-高分子化合物 纤维素-天然高分子化合物 有机玻璃-合成高分子化合物 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源.氢气就是一种高效而没有污染的二级能源.据此判断,下列叙述正确的是( )
| A、天然气是二级能源 |
| B、石油是二级能源 |
| C、煤是一级能源 |
| D、焦炉煤气是一级能源 |
同温同压下,x g的甲气体与y g的乙气体占有相同的体积,则x:y的值可以表示( )
| A、甲与乙的相对分子质量之比 |
| B、等质量的甲和乙的分子个数之比 |
| C、同温同压下甲与乙的密度之比 |
| D、同温同压下,等质量的甲与乙的压强之比 |
下列说法正确的是( )
| A、除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B、电离能最小的电子能量最高 |
| C、同是s能级,在不同的电子层中所能容纳的最多电子数是不相同的 |
| D、核外电子排布完全相同的两种微粒,其化学性质一定相同 |