题目内容
已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.现将8.7gMnO2投入到200g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积;
(2)反应生成的MnCl2的物质的量.
| ||
(1)标准状况下生成Cl2的体积;
(2)反应生成的MnCl2的物质的量.
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算二氧化锰物质的量,再根据方程式计算生成氯气、氯化锰的物质的量,根据V=nVm计算氯气的体积.
| m |
| M |
解答:
解:8.7MnO2的物质的量=
=0.1mol,
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1 1 1
0.1mol n(MnCl2) n(Cl2)
n(MnCl2)=
=0.1mol
n(Cl2)=
=0.1mol
故标况下,生成氯气得到体积=0.1mol×22.4L/mol=2.24L,
答:(1)标准状况下生成Cl2的体积为2.24L;
(2)反应生成的MnCl2的物质的量为0.1mol.
| 8.7g |
| 87g/mol |
MnO2+4HCl(浓)
| ||
1 1 1
0.1mol n(MnCl2) n(Cl2)
n(MnCl2)=
| 0.1mol×1 |
| 1 |
n(Cl2)=
| 0.1mol×1 |
| 1 |
故标况下,生成氯气得到体积=0.1mol×22.4L/mol=2.24L,
答:(1)标准状况下生成Cl2的体积为2.24L;
(2)反应生成的MnCl2的物质的量为0.1mol.
点评:本题考查化学方程式有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、足量的Cu与含有0.2mol H2SO4的浓硫酸共热可生成SO2为0.1 NA |
| B、78 g 苯含有碳碳双键的数目为3NA |
| C、标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.1NA |
| D、25℃,1LpH=1的硫酸溶液中含有的H+数目为0.2NA |
下列试剂都能与抗酸药的有效成分反应的是( )
| A、盐酸 | B、氢氧化钠 |
| C、氯化铝 | D、碳酸 |
 A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的是( )
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的是( )| A、B与C均存在同素异形体 |
| B、X的种类比Y的多 |
| C、沸点:A的氢化物小于C的氢化物 |
| D、A的原子半径最小 |
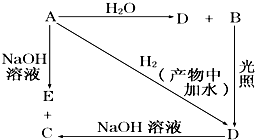 常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.
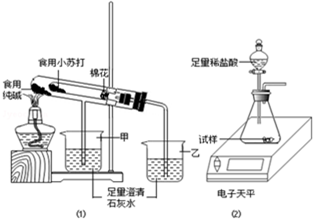 某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.