题目内容
合成氨工厂常通过测定反应前后混合气体的密度来确定氮的转化率.某工厂测得合成塔中N2、H2混合气体的密度为0.379g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L.求该合成氨厂N2的转化率.(写出计算过程)
考点:化学方程式的有关计算
专题:计算题
分析:先根据M=ρVm计算混合气体的平均摩尔质量,计算反应前混合气体中N2和H2的物质的量之比,假设氮气、氢气的起始物质的量,设转化的氮气为ymol,表示出反应结束后各组分的物质的量,再根据平均摩尔质量列方程计算,进而计算氮气的转化率.
解答:
解:设反应前混合气体中氮气的物质的量分数为x,氢气物质的量分数为(1-x),依题意得:
28x+2(1-x)=0.379×22.4
解得x=0.25
所以N2、H2的物质的量之比为0.25:(1-0.25)=1:3,
设起始N2的物质的量为1mol,H2为3 mol,N2的转化量为y mol,则:
N2 +3 H2 ?2 NH3
开始(mol):1 3 0
变化(mol):y 3y 2y
结束(mol):1-y 3-3y 2y
总物质的量=(1-y+3-3y+2y)mol=(4-2y)mol
=0.693×22.4
解得 y=0.905
所以N2的转化率为
×100%=90.5%,
答:该合成氨厂N2的转化率为90.5%.
28x+2(1-x)=0.379×22.4
解得x=0.25
所以N2、H2的物质的量之比为0.25:(1-0.25)=1:3,
设起始N2的物质的量为1mol,H2为3 mol,N2的转化量为y mol,则:
N2 +3 H2 ?2 NH3
开始(mol):1 3 0
变化(mol):y 3y 2y
结束(mol):1-y 3-3y 2y
总物质的量=(1-y+3-3y+2y)mol=(4-2y)mol
| 28×1+2×3 |
| 4-2y |
解得 y=0.905
所以N2的转化率为
| 0.905mol |
| 1mol |
答:该合成氨厂N2的转化率为90.5%.
点评:本题考查混合物计算、化学方程式计算,注意利用三段式解答,难度不大.

练习册系列答案
相关题目
下列物质中属于非电解质的是( )
| A、盐酸 |
| B、氨水 |
| C、H2SO4 |
| D、SO3 |
 已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 |
| C、向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
| D、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
下列化合物既可以通过单质化合,也可以通过溶液中的复分解反应来制取的是( )
| A、CuCl2 |
| B、CuS |
| C、Al2S3 |
| D、Fe2I3 |
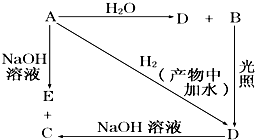 常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.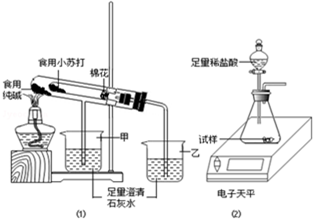 某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究. 根据如图装置回答:
根据如图装置回答: