题目内容
用0.16gNaOH与H2SO4进行中和反应.当NaOH与H2SO4恰好完全中和时,需要H2SO4的物质的量是 ,需要0.1mol/LH2SO4溶液 mL.
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算氢氧化钠的物质的量,根据2NaOH+H2SO4=Na2SO4+2H2O,计算消耗硫酸的物质的量,再根据V=
计算需要硫酸的体积.
| m |
| M |
| n |
| c |
解答:
解:0.16g NaOH的物质的量=
=0.004mol,
2 NaOH+H2SO4=Na2SO4+2H2O
2 1
0.004mol n(H2SO4)
n(H2SO4)=
=0.002mol
故V(H2SO4)=
=0.02L=20mL,
故答案为:0.002mol;20.
| 0.16g |
| 40g/mol |
2 NaOH+H2SO4=Na2SO4+2H2O
2 1
0.004mol n(H2SO4)
n(H2SO4)=
| 0.004mol×1 |
| 2 |
故V(H2SO4)=
| 0.002mol |
| 0.1mol/L |
故答案为:0.002mol;20.
点评:本题以中和滴定为载体,考查化学方程式计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
下列溶液中的物质的量浓度为1mol/L的是( )
| A、将22.4 L氯化氢气体溶于水配成1 L溶液 |
| B、将40 g NaOH溶于1L水中配成溶液 |
| C、从1 L 1 mol/L的NaOH溶液中取出50 mL,则取出的溶液中溶质的物质的量浓度 |
| D、将1 L 10 mol/L的浓盐酸与9 L水混合 |
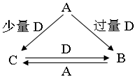 A、B、C、D均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则A不可能是( )
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则A不可能是( )| A、金属单质 | B、非金属单质 |
| C、两性氧化物 | D、碱 |
下列物质属于纯净物的是( )
| A、氯气 | B、氨水 | C、盐酸 | D、碘酒 |
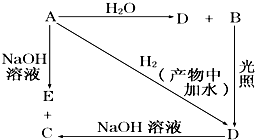 常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.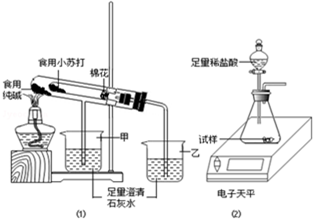 某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.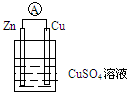 根据如图装置回答:
根据如图装置回答: