题目内容
5.下列说法不正确的是( )| A. | 增加反应物浓度可以增加单位体积活化分子数目,但活化分子百分数保持不变 | |
| B. | 升高温度可以提高活化分子的百分数,从而提高反应速率 | |
| C. | 对于任何反应,压缩容器容积来增大压强,反应速率都加快 | |
| D. | 催化剂可以降低反应所需要的活化能,提高活化分子的百分数,从而提高反应速率 |
分析 A.增加反应物浓度只改变单位体积活化分子数目;
B.升高温度,可增加化学分子百分数;
C.增大压强,只有改变浓度,反应速率才改变;
D.催化剂可降低反应的活化能.
解答 解:A.增加反应物浓度可增大单位体积活化分子数目,活化分子的百分数不变,故A正确;
B.升高温度,可使更多分子转化为活化分子,可增加化学分子百分数,故B正确;
C.如为固体或纯液体,则增大压强,浓度不变,反应速率不变,故C错误;
D.催化剂可降低反应的活化能,增大活化分子百分数,故D正确.
故选C.
点评 本题考查化学反应速率以及化学平衡的影响因素,为高频考点,侧重于学生的分析能力和双基的考查,注意把握化学反应速率的影响因素以及原因,难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
16. 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
13.下列有关化学用语表示正确的是( )
| A. | 对烃基苯甲醛的结构简式: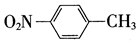 | B. | 质量数为37的氯原子:$\stackrel{37}{17}$Cl | ||
| C. | NH4Br的电子式: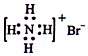 | D. | 二氧化碳分子的比例模型: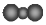 |
20.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 16g氧气和臭氧的混合物中含有的氧原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的氧原子数为NA | |
| C. | NA个氯气分子的体积为22.4L | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有的Cl-个数为NA |
10.符合图中阴影部分的物质是( )


| A. | K2SO3 | B. | K2S2O3 | C. | K2 SO4 | D. | KHSO4 |
17.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 2υ(AB)=υ(A2) | |
| B. | 容器内三种气体AB、A2、B2共存 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内消耗n mol A2,同时消耗n mol AB |
14.碳酸钠(Na2CO3)俗名纯碱,属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
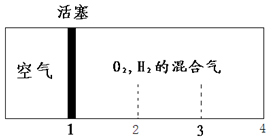 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )