题目内容
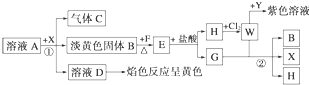
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素的最高正价和其负价的代数和为6.M与其他物质的转化关系如下(部分产物已略去):
(1)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素的原子结构示意图为 ,写出A与B反应的离子方程式 ;E与F反应的离子方程式 .
(2)工业上用电解M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子方程式 .

(1)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素的原子结构示意图为
(2)工业上用电解M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子方程式
考点:无机物的推断
专题:推断题
分析:物质M由同一短周期的X、Y两种元素组成,Y元素最高正价与它的负价代数和为6,则Y是Cl元素,X原子的最外层电子数是最内层电子数的一半,则X是Na元素,则M是NaCl,电解氯化钠溶液生成氢气、氯气和氢氧化钠,
(1)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则A是二氧化硅,所以该元素是硅元素,二氧化硅能和B溶液反应生成E,则B是氢氧化钠溶液,二氧化硅和氢氧化钠溶液生成硅酸钠,氯气和氢气反应生成F为氯化氢,硅酸钠和盐酸反应生成G为硅酸;
(2)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,则该物质是氯气,氯气氧化氰(CN-)生成N2、CO2,自身被还原生成氯离子,据此写出离子方程式.
(1)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则A是二氧化硅,所以该元素是硅元素,二氧化硅能和B溶液反应生成E,则B是氢氧化钠溶液,二氧化硅和氢氧化钠溶液生成硅酸钠,氯气和氢气反应生成F为氯化氢,硅酸钠和盐酸反应生成G为硅酸;
(2)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,则该物质是氯气,氯气氧化氰(CN-)生成N2、CO2,自身被还原生成氯离子,据此写出离子方程式.
解答:
解:物质M由同一短周期的X、Y两种元素组成,Y元素最高正价与它的负价代数和为6,则Y是Cl元素,X原子的最外层电子数是最内层电子数的一半,则X是Na元素,则M是NaCl,电解氯化钠溶液生成氢气、氯气和氢氧化钠,
(1)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则A是二氧化硅,所以该元素是硅元素,二氧化硅能和B溶液反应生成E,则B是氢氧化钠溶液,二氧化硅和氢氧化钠溶液生成E为硅酸钠,氯气和氢气反应生成F为氯化氢,硅酸钠和盐酸反应生成G为硅酸,
硅原子核外有14个电子,其原子结构示意图为: ,二氧化硅和氢氧化钠溶液反应的离子方程式为:SiO2+2OH-═+SiO32-+H2O,盐酸和硅酸钠反应的离子反应方程式为:2H++SiO32-=H2SiO3↓,
,二氧化硅和氢氧化钠溶液反应的离子方程式为:SiO2+2OH-═+SiO32-+H2O,盐酸和硅酸钠反应的离子反应方程式为:2H++SiO32-=H2SiO3↓,
故答案为: ;SiO2+2OH-═+SiO32-+H2O;2H++SiO32-=H2SiO3↓;
;SiO2+2OH-═+SiO32-+H2O;2H++SiO32-=H2SiO3↓;
(2)氯气氧化氰(CN-)生成N2、CO2,自身被还原生成氯离子,其离子反应方程式为:5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O,
故答案为:5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O.
(1)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则A是二氧化硅,所以该元素是硅元素,二氧化硅能和B溶液反应生成E,则B是氢氧化钠溶液,二氧化硅和氢氧化钠溶液生成E为硅酸钠,氯气和氢气反应生成F为氯化氢,硅酸钠和盐酸反应生成G为硅酸,
硅原子核外有14个电子,其原子结构示意图为:
 ,二氧化硅和氢氧化钠溶液反应的离子方程式为:SiO2+2OH-═+SiO32-+H2O,盐酸和硅酸钠反应的离子反应方程式为:2H++SiO32-=H2SiO3↓,
,二氧化硅和氢氧化钠溶液反应的离子方程式为:SiO2+2OH-═+SiO32-+H2O,盐酸和硅酸钠反应的离子反应方程式为:2H++SiO32-=H2SiO3↓,故答案为:
 ;SiO2+2OH-═+SiO32-+H2O;2H++SiO32-=H2SiO3↓;
;SiO2+2OH-═+SiO32-+H2O;2H++SiO32-=H2SiO3↓;(2)氯气氧化氰(CN-)生成N2、CO2,自身被还原生成氯离子,其离子反应方程式为:5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O,
故答案为:5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O.
点评:本题考查无机物推断,正确推断M是解本题关键,注意离子方程式的正确书写,为学习难点,难度中等.

练习册系列答案
相关题目
在一定温度下可逆反应N2+3H2?2NH3已达到平衡,下列有关说法正确的( )
①1个N≡N键断裂的同时,有3个H-H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N-H 键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成n mol N2,同时生成2n mol NH3
⑦气体的平均相对分子质量不再改变
⑧N2、H2、NH3的分子数一定为1:3:2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变.
①1个N≡N键断裂的同时,有3个H-H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N-H 键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成n mol N2,同时生成2n mol NH3
⑦气体的平均相对分子质量不再改变
⑧N2、H2、NH3的分子数一定为1:3:2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变.
| A、①②③④⑤⑥⑦⑨ |
| B、①②③⑤⑥⑩ |
| C、③④⑤⑥⑦⑧ |
| D、①②③⑤⑥⑦⑨⑩ |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、10 L pH=1的硫酸溶液中含有的H+数为2NA |
D、0.5 mol雄黄(As4S4,结构如右图)含有NA个S-S键 |
 物质A~G是中学化学中常见的物质,这些物质有如图所示的转化关系(部分反应物、生成物没有列出).其中A、B、F含有一种相同的元素,C、D、G含有一种相同的元素,F具有磁性,G为黑色非金属单质.
物质A~G是中学化学中常见的物质,这些物质有如图所示的转化关系(部分反应物、生成物没有列出).其中A、B、F含有一种相同的元素,C、D、G含有一种相同的元素,F具有磁性,G为黑色非金属单质.