题目内容
7.海水中提取溴时,其中一个步骤是用热空气将Br2吹出,这是利用了:挥发性,吹出后可用SO2吸收,反应式为Br2+SO2+2H2O=2HBr+H2SO4.分析 海水中提取溴时,淡化海水得到淡水和卤水,卤水加入氧化剂氧化溴离子为单质溴,通入热空气或水蒸气吹出Br2,利用的是溴单质的易挥发性,再利用酸溶液中溴酸根离子和溴离子发生氧化还原反应得到溴单质.溴单质具有易挥发性;溴与二氧化硫水溶液反应生成硫酸和溴化氢.
解答 解:通入热空气或水蒸气吹出Br2,利用到溴的性质是易挥发,吹出的溴蒸气,用二氧化硫水溶液吸收,单质溴具有氧化性,能把二氧化硫氧化,反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,再用氯气氧化溴化氢后蒸馏,
故答案为:挥发性;Br2+SO2+2H2O=2HBr+H2SO4.
点评 本题考查了海水中提取溴的原理,掌握物质的性质和反应原理是方程式的书写关键,题目较简单.

练习册系列答案
相关题目
17.在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种.
①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;
③橙黄色溶液不能使淀粉溶液变蓝色.
根据上述实验事实推断,下列说法不正确的是( )
①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;
③橙黄色溶液不能使淀粉溶液变蓝色.
根据上述实验事实推断,下列说法不正确的是( )
| A. | 溶液中一定存在Br-、CO32- | B. | 溶液中可能存在NH4+ | ||
| C. | 溶液中一定不存在Fe2+、I-、SO32- | D. | 溶液一定呈酸性 |
18.下列有关物理量相应的单位表达错误的是( )
| A. | 摩尔质量g/mol | B. | 物质的量mol | ||
| C. | 气体摩尔体积 mol/L | D. | 密度 g/cm3 |
4.某溶液仅含 Fe2+?Na+?Al3+?Ba2+?SO42-?NO3-?Cl-中的4种离子,所含离子的物质的量均为1mol,若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)?下列说法不正确的是
( )
( )
| A. | 该溶液中所含的离子是:Fe2+?Na+?SO42-?NO3-? | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变成红棕色 | |
| C. | 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 若向该溶液中加入足量的NaOH 溶液,充分反应后,过滤?洗涤?灼烧,最终所得固体的质量为72g |
11.对于第三周期从左到右的主族元素,下列说法中不正确的是( )
| A. | 原子半径逐渐减小 | B. | 电子层数逐渐增多 | ||
| C. | 最高正化合价逐渐升高 | D. | 元素的非金属性逐渐增强 |
9.下列说法错误的是( )
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油裂解是为了获得更多化工原料,如乙烯、丙烯等 | |
| D. | 石油分馏出来的各馏分是纯净物 |
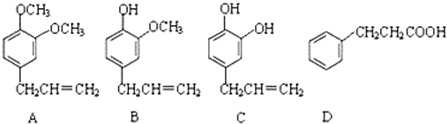
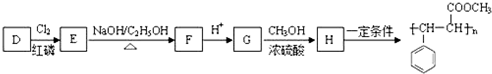
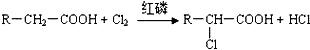
 ;
; .
.