题目内容
11.对于第三周期从左到右的主族元素,下列说法中不正确的是( )| A. | 原子半径逐渐减小 | B. | 电子层数逐渐增多 | ||
| C. | 最高正化合价逐渐升高 | D. | 元素的非金属性逐渐增强 |
分析 同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,结合原子核外最外层电子数的变化判断,以此解答.
解答 解:同周期元素具有相同的电子层数,从左到右元素的金属性逐渐减弱,非金属性逐渐增强,因原子核外最外层电子数逐渐增多,则从左到右,正化合价的数值增大.
故选B.
点评 本题考查同周期元素的性质的递变规律,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol H3O+ 所含质子数为10NA | |
| B. | 40克氖气所含分子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下32 g O2所含原子数不是2NA |
6.下列实验装置及操作不能达到实验目的是( )
| A. |  用Ca(OH)2和NH4Cl制取NH3 | B. | 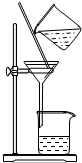 从碘水中提取碘单质 | ||
| C. | 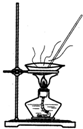 从食盐水中获取氯化钠 | D. | 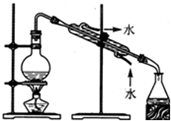 用自来水制取蒸馏水 |
3.碳碳双键不能自由转动,所以R-CH=CH-R′(R、R′为烃基)可有: 两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )
两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )
 两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )
两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )| A. | 乙烯 | B. | 2-戊烯 | C. | 苯乙烯 | D. | 丙烯 |
20.下列数字为几种元素的原子序数,其中位于周期表第三周期的是( )
| A. | 1 | B. | 7 | C. | 8 | D. | 12 |
 在容积为1.00L的容器中,通入一定量的N2O4(g),发生反应,随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4(g),发生反应,随温度升高,混合气体的颜色变深.