题目内容
2.100mL2.00mol/L的Al2(SO4)3溶液中含有Al2(SO4)3的物质的量为0.2Al3+的物质的量的浓度为4mol/L,SO42-的物质的量的浓度为6mol/L,SO42-的物质的量为0.6.分析 根据溶液的浓度和体积计算溶质的物质的量,根据化学式的组成计算铝离子的物质的量浓度和硫酸根离子的浓度,进而计算溶质离子的物质的量,由此分析解答.
解答 解:解:n(Al2(SO4)3)=c•V=0.1L×2.00mol/L=0.2mol;
c(Al3+)=2c(Al2(SO4)3)=2×2.00mol/L=4mol/L;
c(SO42-)=3c(Al2(SO4)3)=3×2.00mol/L=6mol/L;
n(SO42-)=3n(Al2(SO4)3)=3×0.2mol=0.6mol;
故答案为:0.2;4mol/L;6mol/L;0.6.
点评 本题考查物质的量的有关计算,题目难度不大,但易错,注意把握物质的量与质量、浓度计算公式的运用.

练习册系列答案
相关题目
12.下列说法中不正确的是( )
| A. | 溴乙烷发生的取代反应和消去反应说明条件不同产物不同,溴乙烷和乙醇发生的消去反应说明不同官能团发生同一反应类型需要不同的介质条件 | |
| B. | 苯和苯酚发生的溴代反应说明羟基比氢原子更能活化苯环 | |
| C. | 羧基和酚羟基与碳酸氢钠溶液的反应与否说明羰基比苯基更能使羟基活化 | |
| D. | 乙醇和苯酚相对酸性的比较说明乙基比苯环更能使羟基活化 |
10.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol H3O+ 所含质子数为10NA | |
| B. | 40克氖气所含分子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下32 g O2所含原子数不是2NA |
17.在下述条件下,一定能大量共存的离子组是( )
| A. | 无色透明的水溶液中:K+、Ba2+、I-、MnO4- | |
| B. | 使石蕊试液变蓝色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 某澄清溶液中:HCO3-、Na+、Al3+、Br- | |
| D. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
6.下列实验装置及操作不能达到实验目的是( )
| A. |  用Ca(OH)2和NH4Cl制取NH3 | B. | 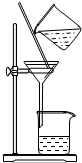 从碘水中提取碘单质 | ||
| C. | 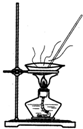 从食盐水中获取氯化钠 | D. | 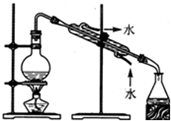 用自来水制取蒸馏水 |
3.碳碳双键不能自由转动,所以R-CH=CH-R′(R、R′为烃基)可有: 两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )
两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )
 两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )
两种空间排列形式,判断下列化合物中具有上述两种空间排列形式的是( )| A. | 乙烯 | B. | 2-戊烯 | C. | 苯乙烯 | D. | 丙烯 |
4.常温下在水电离出的c(H+)为1.0×10-13 mol/L的溶液中,一定能大量共存的是( )
| A. | K+、NH4+、NO3-、Cl- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | Fe2+、Cu2+、NO3-、SO42- | D. | NH4+、K+、I-、NO3- |
 A、B、C、D均为烃的衍生物,它们之间的转化关系如图所示:
A、B、C、D均为烃的衍生物,它们之间的转化关系如图所示: