题目内容
6.下列表示的是化学反应A+2B=C+D在不同条件下的反应速率,其中最快的是( )| A. | v(A)=0.3 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v (C)=0.25 mol•L-1•s-1 | D. | v(D)=0.2 mol•L-1•s-1 |
分析 反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.3}{1}$=0.3;
B.$\frac{0.5}{2}$=0.25;
C.$\frac{0.25}{1}$=0.25;
D.$\frac{0.2}{1}$=0.2;
显然A中比值最大,反应速率最快,
故选A.
点评 本题考查反应速率的比较,为高频考点,把握反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,注意比值法应用及速率单位统一,题目难度不大.

练习册系列答案
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
16.对 SO2与 CO2说法正确的是( )
| A. | 都是直线形结构 | |
| B. | 中心原子都采取 sp1杂化 | |
| C. | 硫原子和碳原子上都没有孤对电子 | |
| D. | SO2 为 V 形结构,CO2为直线形结构 |
17.表中除杂质所用试剂及方法错误的是( )
| 选项 | 物质(杂质) | 除杂质所用试剂及方法 |
| A | 乙醇(水) | 加入生石灰蒸馏 |
| B | 苯(苯酚) | 加入浓溴水振荡后过滤 |
| C | 溴乙烷(溴单质) | 加入NaHSO3溶液振荡、静置、分液 |
| D | 甲烷(乙烯) | 依次通过KMnO4酸性溶液、NaOH溶液洗气 |
| A. | A | B. | B | C. | C | D. | D |
1.铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
铝土矿$→_{①}^{过量NaOH}$a $→_{②}^{过量盐酸}$b$\stackrel{③}{→}$c$\stackrel{④}{→}$d$\stackrel{电解}{→}$Al.
铝土矿$→_{①}^{过量NaOH}$a $→_{②}^{过量盐酸}$b$\stackrel{③}{→}$c$\stackrel{④}{→}$d$\stackrel{电解}{→}$Al.
| A. | b中铝元素是以阳离子形式存在 | |
| B. | ①、②中除加试剂外,还需要进行过滤操作 | |
| C. | ④进行的操作是加热,而且d一定是氧化铝 | |
| D. | ③中需要通入过量的二氧化碳 |
11.下列说法错误的是( )
| A. | 一定条件下,苯酚可以和甲醛发生加聚反应生成酚醛树脂 | |
| B. | 聚丙烯酸钠属于功能高分子材料,具有较强的吸水性 | |
| C. | 酶是具有催化作用的蛋白质,在光、热、酸、碱、重金属离子、乙醇等作用下会失去活性 | |
| D. | 淀粉溶液、肥皂水都是胶体,都有丁达尔效应 |
18.下列金属与水反应最剧烈的是( )
| A. | 锂 | B. | 钠 | C. | 钾 | D. | 铷 |
18.有甲、乙、丙、丁四种金属,甲、乙能与酸反应放出氢气,丙、丁不能;乙能与水反应放出氢气,甲不能;丙、丁用导线相连浸入AgNO3溶液中,丙金属逐渐溶解.则四种金属的活泼性由强到弱的顺序为( )
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丁、丙 | C. | 甲、乙、丁、丙 | D. | 乙、甲、丙、丁 |
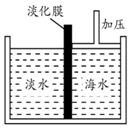 海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.