题目内容
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质.我们食用的精盐是用粗食盐提纯而得到的.通过教材中“粗盐的提纯”及你做过的该实验回答下列问题.
(1)如何运用最简单的方法检验溶液中有无SO42-离子? .
如果有,应该如何除去SO42-离子? .
(2)在粗盐经过一定处理后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止.请问这步操作的目的是 .
(3)将经过操作(2)后的溶液过滤.请问这一操作能除掉哪些物质? .
(1)如何运用最简单的方法检验溶液中有无SO42-离子?
如果有,应该如何除去SO42-离子?
(2)在粗盐经过一定处理后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止.请问这步操作的目的是
(3)将经过操作(2)后的溶液过滤.请问这一操作能除掉哪些物质?
考点:常见阴离子的检验,物质的分离、提纯和除杂
专题:物质检验鉴别题,化学实验基本操作
分析:(1)加入氯化钡溶液检验硫酸根离子是否除尽;
(2)在粗盐提纯的过程中需要滴加饱和Na2CO3溶液除去钙离子以及过量的钡离子;
(3)过滤可把溶液和不溶于水的物质除去.
(2)在粗盐提纯的过程中需要滴加饱和Na2CO3溶液除去钙离子以及过量的钡离子;
(3)过滤可把溶液和不溶于水的物质除去.
解答:
解:(1)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽;
除去硫酸根离子的方法是在溶液中加入过量的氯化钡溶液;
故答案为:静置片刻后,取上层清液于试管中,滴加氯化钡,若出现浑浊或白色沉淀,说明溶液中含有硫酸根离子,反之则没有;除去硫酸根离子的方法是在溶液中加入过量的氯化钡溶液;
(2)碳酸钠与镁离子生成碳酸镁沉淀、与钙离子生成碳酸钙沉淀、与钡离子生成碳酸钡沉淀,所以滴加饱和碳酸钠溶液,可以除去钙离子、镁离子和过量的钡离子;
故答案为:除去Ca2+、Mg2+以及加入过量的Ba2+;
(3)过滤可把溶液和不溶于水的物质除去,可以除去硫酸钡、碳酸钙、碳酸镁、碳酸钡和泥沙等不溶性杂质;
故答案为:BaSO4、BaCO3、CaCO3、MgCO3等杂质.
除去硫酸根离子的方法是在溶液中加入过量的氯化钡溶液;
故答案为:静置片刻后,取上层清液于试管中,滴加氯化钡,若出现浑浊或白色沉淀,说明溶液中含有硫酸根离子,反之则没有;除去硫酸根离子的方法是在溶液中加入过量的氯化钡溶液;
(2)碳酸钠与镁离子生成碳酸镁沉淀、与钙离子生成碳酸钙沉淀、与钡离子生成碳酸钡沉淀,所以滴加饱和碳酸钠溶液,可以除去钙离子、镁离子和过量的钡离子;
故答案为:除去Ca2+、Mg2+以及加入过量的Ba2+;
(3)过滤可把溶液和不溶于水的物质除去,可以除去硫酸钡、碳酸钙、碳酸镁、碳酸钡和泥沙等不溶性杂质;
故答案为:BaSO4、BaCO3、CaCO3、MgCO3等杂质.
点评:本题考查在粗盐提纯的过程中所选用除杂和净化的方法,难度不大,除去杂质不要引入新的杂质,对于实验过程中所加过量的试剂都要除去.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
在铁和氧化铁混合物15g中,加入稀硫酸150mL,能发出H21.68L(标准状况).同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化.为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3mol?L-1的NaOH溶液200mL,则硫酸的物质的量浓度是( )
| A、1.5mol?L-1 |
| B、2mol?L-1 |
| C、2.5mol?L-1 |
| D、3mol?L-1 |
在120℃,101Kpa下,下列各组烃不论以何种比例混合,在足量氧气中点燃,恢复到原状况体积没有变化的是( )
| A、CH4 C2H8 |
| B、C2H4 C2H2 |
| C、C2H2 C2H6 |
| D、CH4 C2H4 |
某金属硝酸盐加热分解生成的NO2和O2的物质的量之比是3:1,则在加热过程中,该金属元素的化合价( )
| A、降低 | B、升高 |
| C、不变 | D、无法确定 |
某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.下列叙述正确的是( )
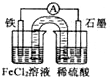

| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、此电池工作原理与硅太阳能电池工作原理相同 |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、若装置中的盐桥用铁丝代替,电流表指针无偏转 |
 ①实验室制氧气时,应选用的发生装置是
①实验室制氧气时,应选用的发生装置是