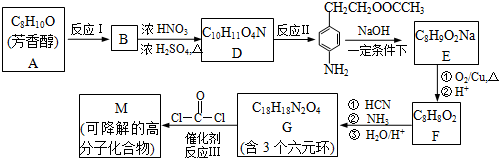
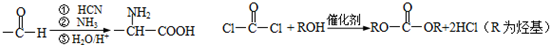题目内容
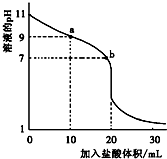 室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A、b点:c(M+)+c(MOH)=c(Cl-) |
| B、a到b点的水溶液导电性依次增强 |
| C、该一元碱溶液浓度为0.100 0 mol?L-1 |
| D、室温下,MOH的电离常数Kb=1×10-5 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据溶液酸碱性结合电荷守恒判断.
B.溶液的导电能力与离子浓度成正比;
C.根据图象知,当盐酸体积为20mL时二者恰好反应生成盐,则二者的物质的量相等;
D.常温下,MOH的电离常数Kb=
;
B.溶液的导电能力与离子浓度成正比;
C.根据图象知,当盐酸体积为20mL时二者恰好反应生成盐,则二者的物质的量相等;
D.常温下,MOH的电离常数Kb=
| c(M+)c(OH-) |
| c(MOH) |
解答:
解:A.b点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(Cl-),所以得c(M+)=c(Cl-),故A错误;
B.溶液的导电能力与离子浓度成正比,MOH是弱电解质,HCl、MCl是强电解质,完全电离,根据图象知,a到b点的水溶液中,溶液中自由移动离子浓度逐渐增大,所以其导电性依次增强,故B正确;
C.根据图象知,当盐酸体积为20mL时二者恰好反应生成盐,则二者的物质的量相等,二者的体积相等,则其浓度相等,所以一元碱溶液浓度为0.100 0 mol?L-1,故C正确;
D.根据图象知,0.1000mol/LMOH溶液中pH=11,则c(OH-)=0.001mol/L,常温下,MOH的电离常数Kb=
=
=1×10-5,故D正确;
故选A.
B.溶液的导电能力与离子浓度成正比,MOH是弱电解质,HCl、MCl是强电解质,完全电离,根据图象知,a到b点的水溶液中,溶液中自由移动离子浓度逐渐增大,所以其导电性依次增强,故B正确;
C.根据图象知,当盐酸体积为20mL时二者恰好反应生成盐,则二者的物质的量相等,二者的体积相等,则其浓度相等,所以一元碱溶液浓度为0.100 0 mol?L-1,故C正确;
D.根据图象知,0.1000mol/LMOH溶液中pH=11,则c(OH-)=0.001mol/L,常温下,MOH的电离常数Kb=
| c(M+)c(OH-) |
| c(MOH) |
| (0.0001)2 |
| 0.1000 |
故选A.
点评:本题考查了酸碱混合溶液定性判断,明确图象中各个点的含义是解本题关键,结合电荷守恒来分析解答,注意溶液的导电能力与离子浓度的关系,难度中等.

练习册系列答案
相关题目
欲检验某无色溶液中是否含有SO42-,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
| A、先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B、先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C、直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D、直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
下列离子方程式中正确的是( )
| A、氨水与亚硫酸溶液混合:NH3?H2O+H+═NH4++H2O | ||||
| B、SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
| D、把H2S通入CuSO4溶液中:H2S+Cu2+═CuS↓+2H+ |
对于VIIA族元素,下列说法不正确的是( )
| A、可形成-l价离子 |
| B、从上到下原子半径逐渐减小 |
| C、从上到下原子半径逐渐增大 |
| D、从上到下非金属性逐渐减弱 |
下列有机物的命名肯定错误的是( )
| A、3-甲基-2-戊烯 |
| B、2-甲基-2-丁烯 |
| C、2,2-二甲基丙烷 |
| D、2-甲基-3-丁炔 |
金刚石和石墨是碳元素的两种结构不同的单质.在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量.下列说法不正确的是( )
| A、石墨比金刚石稳定 |
| B、金刚石与石墨中的化学性质相似 |
| C、1mol金刚石比1mol石墨的总能量高 |
| D、1mol石墨和金刚石完全燃烧时释放的能量石墨比金刚石多 |
下列有关化学用语正确的是( )
A、HCl的电子式为 | ||
B、Cl-的结构示意图  | ||
C、氮气的电子式  | ||
D、质量数为37的氯原子
|