题目内容
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
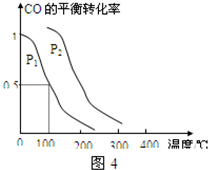
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
①该反应化学平衡常数表达式K=
②由表中数据判断该反应的△H 0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得C(CO)=0.2mol?L-1,此时的温度为
(3)25℃101KPa下,1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,表示甲醇燃烧热的热化学方程式为
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,该电池工作时负极电极反应式为 .若反应时消耗16g甲醇所产生的电能电解足量的CuSO4溶液,则将产生标准状况下的O2 升.
(1)判断反应达到平衡状态的依据是(填字母序号)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②由表中数据判断该反应的△H
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得C(CO)=0.2mol?L-1,此时的温度为
(3)25℃101KPa下,1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,表示甲醇燃烧热的热化学方程式为
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,该电池工作时负极电极反应式为
考点:化学平衡状态的判断,热化学方程式,化学电源新型电池,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(2)①反应化学平衡常数是平衡时生成的浓度幂之积除以反应物浓度的幂之积;
②升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
③根据平衡浓度计算出平衡常数来确定温度;
(3)1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,然后求出1mol放出的热量;
(4)负极发生氧化反应,根据电子守恒求产生标准状况下的O2.
(2)①反应化学平衡常数是平衡时生成的浓度幂之积除以反应物浓度的幂之积;
②升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
③根据平衡浓度计算出平衡常数来确定温度;
(3)1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,然后求出1mol放出的热量;
(4)负极发生氧化反应,根据电子守恒求产生标准状况下的O2.
解答:
解:(1)A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选CD;
(2))①反应化学平衡常数是平衡时生成的浓度幂之积除以反应物浓度的幂之积,K=
,故答案为:
;
②升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
③CO(g)+2H2(g)?CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=
=2.04,所以是250℃;
故答案为:250℃;
(3)1mol放出的热量为725.76 kJ/mol,所以热化学方程式为 CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJ/mol,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJ/mol;
(4)负极发生氧化反应,负极CH3OH-6e-+8OH-=CO32-+6H2O 依据电子守恒CH3OH~CO32-~6e-,16克甲醇物质的量为0.5mol,转移电子为3mol,依据电子守恒O2~4e-,则将产生标准状况下的O2物质的量为0.75mol,标准状况下氧气的体积=0.75mol×22.4L/mol=16.8L,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;16.8.
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选CD;
(2))①反应化学平衡常数是平衡时生成的浓度幂之积除以反应物浓度的幂之积,K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
②升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
③CO(g)+2H2(g)?CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=
| 0.8mol/L |
| 0.2mol/L.(1.4mol/L)2 |
故答案为:250℃;
(3)1mol放出的热量为725.76 kJ/mol,所以热化学方程式为 CH3OH(l)+
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(4)负极发生氧化反应,负极CH3OH-6e-+8OH-=CO32-+6H2O 依据电子守恒CH3OH~CO32-~6e-,16克甲醇物质的量为0.5mol,转移电子为3mol,依据电子守恒O2~4e-,则将产生标准状况下的O2物质的量为0.75mol,标准状况下氧气的体积=0.75mol×22.4L/mol=16.8L,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;16.8.
点评:本题考查了影响化学平衡移动的因素、平衡状态的判断等知识点.

练习册系列答案
相关题目
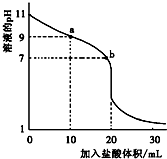 室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A、b点:c(M+)+c(MOH)=c(Cl-) |
| B、a到b点的水溶液导电性依次增强 |
| C、该一元碱溶液浓度为0.100 0 mol?L-1 |
| D、室温下,MOH的电离常数Kb=1×10-5 |
 如图是利用试纸、铅笔芯设计的微型实验.以铅笔芯为电极,分别接触表面皿上的试纸,接通电源,观察实验现象.下列说法错误的是( )
如图是利用试纸、铅笔芯设计的微型实验.以铅笔芯为电极,分别接触表面皿上的试纸,接通电源,观察实验现象.下列说法错误的是( )| A、pH试纸变蓝 |
| B、KI-淀粉试纸变蓝 |
| C、通电时,电能转换为化学能 |
| D、电子通过pH试纸到达KI-淀粉试纸 |
化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
| D、海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
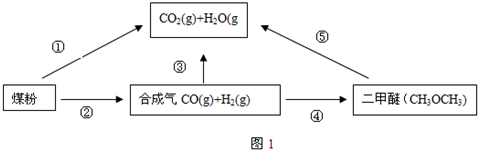
 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: