题目内容
10.下列实验设计及其对应的离子方程式均正确的是( )| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| D. | 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
分析 A.氯化铁与铜反应生成氯化亚铁和氯化铜;
B.2mol过氧化钠与水完全反应生成1mol氧气,该反应不满足电子守恒;
C.硫离子的水解分步进行,离子方程式应该分步书写,主要写出第一步水解即可;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A.用FeCl3溶液腐蚀铜线路板,二者反应生成氯化亚铁和氯化铜,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故A正确;
B.Na2O2与H2O反应生成氢氧化钠和O2,正确的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故B错误;
C.硫化钠水溶液中,硫离子的水解分步进行,主要以第一步为主,正确的离子方程式为:S2-+H2O?HS-+OH-,故C错误;
D.铝粉与NaOH溶液反应产生H2和偏铝酸钠,正确的离子方程式为:2A1+2OH-+2H2O=2AlO2-+3H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
1.下列有关化学用语表示正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 1H、2H、3H是同一种核素 | ||
| C. | S2-的结构示意图: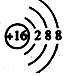 | D. | 四氯化碳的电子式: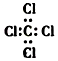 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等 | |
| B. | 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA | |
| C. | 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA | |
| D. | 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA |
15.不需要通过氧化还原反应就能从海水中获得的物质是( )
| A. | 液溴 | B. | 精盐 | C. | 钠 | D. | 烧碱 |
2.某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件.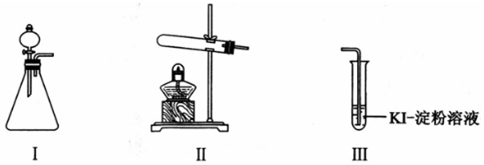
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如表:
(2)丙实验中O2与KI溶液反应的离子方程式是O2+4I-+4H+=2I2+2H2O.
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是酸性环境.为进一步探究该条件对反应速率的影响,可采取的实验措施是使用不同浓度的稀硫酸作对比实验.
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝.学生将I中产生的气体直接通入下列AD溶液(填序号),证明了白雾中含有H2O2.
A.酸性 KMnO4 B.FeCl2 C.Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)3I2+6OH-=5I-+IO3-+3H2O造成的,请设计实验证明他们的猜想是否正确在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误.

供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如表:
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入MnO2固体,.向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是酸性环境.为进一步探究该条件对反应速率的影响,可采取的实验措施是使用不同浓度的稀硫酸作对比实验.
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝.学生将I中产生的气体直接通入下列AD溶液(填序号),证明了白雾中含有H2O2.
A.酸性 KMnO4 B.FeCl2 C.Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)3I2+6OH-=5I-+IO3-+3H2O造成的,请设计实验证明他们的猜想是否正确在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误.
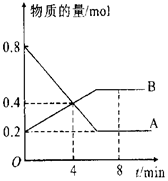 在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题:
在一定条件下,在4L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,据图分析回答下列问题: 钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示:
钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示: