题目内容
下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A | 室温下,使用pH计分别测定浓度均为0.1mol/L NaClO溶液CH3COONa | 比较HClO和CH3COOH的酸性强弱 |
B | 室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的CuSO4、FeSO4溶液,观察产生气泡的快慢。 | 比较CuSO4、FeSO4作为催化剂对H2O2分解速率的影响 |
C | 向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化。 | 比较AgCl与AgI溶解度的相对大小 |
D | 向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,加热并搅拌,过滤。 | 除去MgCl2酸性溶液含有的少量FeCl3 |
B
【解析】
试题分析:A.NaClO和CH3COONa都是强碱弱酸盐,在溶液中弱酸根离子发生水解反应,使溶液显碱性。形成盐的酸的酸性越弱,则酸根离子的水解程度就越大,溶液的碱性就越强。故可以通过比较相同浓度的NaClO溶液CH3COONa的pH大小来比较HClO和CH3COOH的酸性强弱,正确;B.Cu2+、Fe3+都可以作H2O2分解的催化剂。室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的CuSO4、Fe2(SO4)3溶液,由于盐溶液的阴离子相同,而阳离子不同,故可以通过观察产生气泡的快慢来比较CuSO4、Fe2(SO4)3作为催化剂对H2O2分解速率的影响,但是FeSO4有还原性,可以与H2O2发生氧化还原反应,就不能作为对H2O2分解速率催化剂,错误。C.向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,在溶液中存在AgCl的沉淀溶解平衡。当再向其中滴入0.1mol/L KI溶液,时,如果沉淀颜色由白色变为黄色,说明AgCl的溶解度大于AgI,发生了沉淀的转化,故可以比较AgCl与AgI溶解度的相对大小,正确。D.向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,由于Mg(OH)2在溶液中存在沉淀溶解平衡,由于Fe(OH)3的溶解度小于Mg(OH)2,加热并搅拌,会发生沉淀转化,杂质Fe3+形成Fe(OH)3,然后将沉淀过滤,就可以达到除杂的目的,正确。
考点:考查化学实验设计与完成预期实验目的的关系的知识。

除去被提纯物质中的杂质,方案正确的是
编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
B. | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
C. | 苯 | 苯酚 | 浓溴水 | 过滤 |
D. | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
 B.
B. C.
C.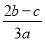 D.
D.

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态

