题目内容
关于下列各图的叙述正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
D
【解析】
试题分析;A、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则根据图像可知生成物是水蒸气,所以H2的标准燃烧热△H不等于-483.6kJ·mol-1,A错误;B、根据图像可知交点A只表示NO2和N2O4的反应速率相等,并不能表示化学平衡状态,B不正确;C、将tl℃时A、B的饱和溶液分别升温至t2℃时,没有晶体析出,因此溶质的质量分数B=A,C错误;D、丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,根据图像可知HA的pH变化大,说明HA的酸性强于HB,则A-的水解程度小于B-的水解程度,因此NaA溶液的pH小于同浓度的NaB溶液的pH,D正确,答案选D。
考点:考查燃烧热、平衡状态、溶解度、弱电解质的电离以及盐类水解等

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案(14分)( I )在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) 2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g),已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0,熵变△S_____0 ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。

(2)该反应的v-t图像如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。以下说法正确的是 。
① a1>a2 ②b1<b2 ③ t1>t2 ④ 右图中阴影部分面积更大 ⑤两图中阴影部分面积相等
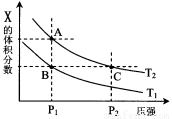
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g) pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左,向右,不)。
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.。
(3)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。

(18分)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用研究。
(1)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是___ _(填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,
一定条件下发生反应:CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H=-49.0 kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
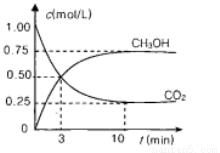
的转化率= ;能使平衡体系中n(CH3OH)增大的措施有 。
(2)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
己知:①CH4(g)+2O2(g)=CO2(g)+2H2O( l ) △H=-890.3kJ/mol
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(3)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
溶解度(s)/g | 溶度积(Ksp) | ||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
吸收CO2最合适的试剂是__ __(填“Ca(OH)2”或“Ba(OH)2”)溶液。
下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A | 室温下,使用pH计分别测定浓度均为0.1mol/L NaClO溶液CH3COONa | 比较HClO和CH3COOH的酸性强弱 |
B | 室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的CuSO4、FeSO4溶液,观察产生气泡的快慢。 | 比较CuSO4、FeSO4作为催化剂对H2O2分解速率的影响 |
C | 向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化。 | 比较AgCl与AgI溶解度的相对大小 |
D | 向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,加热并搅拌,过滤。 | 除去MgCl2酸性溶液含有的少量FeCl3 |

