题目内容
完成下列计算
(1)相同物质的量的O2和O3的质量比 ,分子个数比为 ,所含氧原子的个数比为 .
(2)在200mL 2mol/L MgCl2溶液中,溶质的质量为 .此溶液中Mg2+的物质的量浓度为 ,Cl-的物质的量浓度为 .
(3)在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是 .
(1)相同物质的量的O2和O3的质量比
(2)在200mL 2mol/L MgCl2溶液中,溶质的质量为
(3)在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是
考点:物质的量的相关计算
专题:计算题
分析:(1)根据m=nM计算二者质量之比,由N=nNA可知,分子数目之比等于物质的量之比;氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍;
(2)根据n=cV计算氯化镁的物质的量,再根据m=nM计算氯化镁的质量,氯化镁完全电离,1mol氯化镁电离得到1mol镁离子、2mol氯离子,故溶液中c(Mg2+)=c(MgCl2)、c(Cl-)=2c(MgCl2);
(3)假设溶液质量为100g,计算KOH、水的质量,再根据c=
计算KOH、水的物质的量,进而计算OH-与H2O数目之比.
(2)根据n=cV计算氯化镁的物质的量,再根据m=nM计算氯化镁的质量,氯化镁完全电离,1mol氯化镁电离得到1mol镁离子、2mol氯离子,故溶液中c(Mg2+)=c(MgCl2)、c(Cl-)=2c(MgCl2);
(3)假设溶液质量为100g,计算KOH、水的质量,再根据c=
| m |
| M |
解答:
解:(1)根据m=nM可知,相同物质的量的O2和O3的质量之比=32g/mol:48g/mol=2:3,由N=nNA可知,分子数目之比等于物质的量之比=1:1;氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍,故相同物质的量的O2和O3含有氧原子数目之比=1×2:1×3=2:3,
故答案为:2:3;1:1;2:3;
(2)氯化镁的物质的量=0.2L×2mol/L=0.4mol,故氯化镁的质量=0.4mol×95g/mol=38g,氯化镁完全电离,1mol氯化镁电离得到1mol镁离子、2mol氯离子,故溶液中c(Mg2+)=c(MgCl2)=2mol/L、c(Cl-)=2c(MgCl2)=2×2mol/L=4mol/L,
故答案为:38g;2mol/L;4mol/L;
(3)假设溶液质量为100g,则KOH的质量=100g×28%=28g,故水的质量=100g-28g=72g,故KOH的物质的量=
=0.5mol、水的物质的量=
=4mol,故溶液中OH-与H2O数目之比=0.5mol:4mol=1:8,
故答案为:1:8.
故答案为:2:3;1:1;2:3;
(2)氯化镁的物质的量=0.2L×2mol/L=0.4mol,故氯化镁的质量=0.4mol×95g/mol=38g,氯化镁完全电离,1mol氯化镁电离得到1mol镁离子、2mol氯离子,故溶液中c(Mg2+)=c(MgCl2)=2mol/L、c(Cl-)=2c(MgCl2)=2×2mol/L=4mol/L,
故答案为:38g;2mol/L;4mol/L;
(3)假设溶液质量为100g,则KOH的质量=100g×28%=28g,故水的质量=100g-28g=72g,故KOH的物质的量=
| 28g |
| 56g/mol |
| 72g |
| 18g/mol |
故答案为:1:8.
点评:本题考查物质的量及溶液浓度有关计算,难度不大,(2)中注意理解电解质溶液中离子浓度与电解质的浓度关系,(3)中注意利用赋值法解答,简化计算过程.

练习册系列答案
相关题目
向盛有KI溶液的试管中加入一定量CCl4后,滴加少量氯水,振荡,CCl4层变成紫色,继续滴加氯水,振荡,CCl4层颜色会逐渐变浅直至无色.下列说法正确的是( )
| A、CCl4层显紫色是因为有I2生成 |
| B、溶液分两层,紫色层在上层 |
| C、CCl4层显紫色是因为有Cl2生成 |
| D、CCl4层颜色最终会变为无色因为I2会升华 |
1molCH4与一定量的氯气在光照条件下发生取代反应,若产生的四种取代物的物质的量相等,则反应生成HCl的物质的量为( )
| A、1.25mol |
| B、2mol |
| C、2.5mol |
| D、4mol |
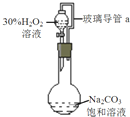 过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验: