题目内容
4.为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上采用生石灰和含硫的煤混合使用以“固硫”(避免硫的化合物进入大气),最后生成石膏.试回答:(1)整个“固硫”反应所涉及的反应类型包括:①化合反应②分解反应③置换反应④复分解反应③氧化还原反应③非氧化还原反应⑦离子反应⑧非离子反应(分子反应).其中正确的是( )
A.①⑤⑥⑦B.①②③⑤⑧C.①⑤⑥⑧D.②④⑤⑦
(2)第一步“固硫”反应的化学方程式中所需气态物质的化学计量数为( )
A.1 B.2 C.3 D.4
(3)你认为减少酸雨产生可采取的措施是( )
①少用煤做燃料 ②把工厂的烟囱造高 ③先将燃料煤脱硫 ④在土壤中加石灰防止酸化 ⑤开发新能源,避免含S、N的氧化物大量排放
A.①②③B.②③④⑤C.①③⑤D.①③④⑤
分析 工业上采用生石灰和含硫的煤混合使用以“固硫”,涉及反应有S与氧气反应生成SO2,反应方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,SO2与CaO反应生成CaSO3,反应方程式为CaO+SO2═CaSO3,进一步反应生成CaSO4,反应方程式为2CaSO3+O2═CaSO4,以此解答该题.
解答 解:工业上采用生石灰和含硫的煤混合使用以“固硫”,涉及反应有S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2、CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4,
(1)S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2、CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4都是化合反应,且S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2、2CaSO3+O2═2CaSO4属于氧化还原反应,CaO+SO2═CaSO3属于非氧化还原反应,都是不离子反应,
故答案为:C;
(2)第一步“固硫”反应的化学方程式为2CaSO3+O2═2CaSO4,所需气态物质的化学计量数为1,
故答案为:A;
(3)把工厂烟囱造高、在已酸化的土壤中加石灰等措施不能从源头有效地防止酸雨的形成,少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成.
故答案为:C.
点评 本题考查二氧化硫的污染及治理,侧重于基础知识的考查,注意把握二氧化硫的性质,为解答该题的关键,该题有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
14.下列说法中正确的是( )
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
15. 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
Na2SX$?_{放电}^{充电}$2Na+xS ( 3<x<5 )
(1)根据如表数据,判断该电池工作的适宜温度应为C(选填字母序号).
A.100℃以下
B.100℃~300℃
C.300℃~350℃
D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是AD(选填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.05mol,两极的反应物的质量差为2.3g(假设电解前两极的反应物的质量相等).
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS ( 3<x<5 )
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下
B.100℃~300℃
C.300℃~350℃
D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是AD(选填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.05mol,两极的反应物的质量差为2.3g(假设电解前两极的反应物的质量相等).
16.下列事实与胶体性质无关的是( )
| A. | 夏日的傍晚常常看到万丈霞光穿云而过美不胜收 | |
| B. | 受伤时,在流血的伤口上抹一点FeCl3可以止血 | |
| C. | “尿毒症”患者做血液透析治疗 | |
| D. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
13.对于可逆反应A(s)+B(aq)?C(aq)+D(aq)的化学平衡,下列说法正确的是( )
| A. | 温度不变,增大A的物质的量,化学平衡右移 | |
| B. | 温度不变,增大B的浓度,V正增大,V逆减小,化学平衡右移 | |
| C. | 温度不变,减小C的浓度,V逆减小,V正减小,化学平衡右移 | |
| D. | 温度不变,增大D的浓度,同时增大B的浓度,化学平衡一定向左移动 |
1.下列叙述正确的是( )
| A. | 等浓度的三种溶液:醋酸钠溶液pH=a,碳酸氢钠溶液pH=b,碳酸钠溶液pH=c,则c>a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH=7 | |
| C. | MgCl2溶液蒸发、结晶得MgCl2•6H2O | |
| D. | 常温下,若1mL pH=1盐酸与100mL NaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11 |
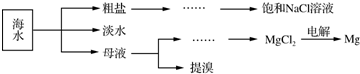
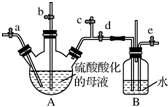
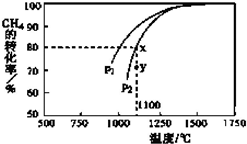 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
 .
.