题目内容
合成氨对人类社会发展具有重要意义,结合有关合成氨信息,请按要求回答下列问题.
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2
2NH3.则在电解法合成氨的过程中,应将不断地通入 极(填“阴”或“阳”):向另一电极通入N2,该电极的反应式为 .
Ⅱ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应:
2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H═+1266kJ/mol
(1)上述反应的平衡常数表达式为 .
(2)若上述反应在有催化剂的情况下发生,则如图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是 (填字母代号).
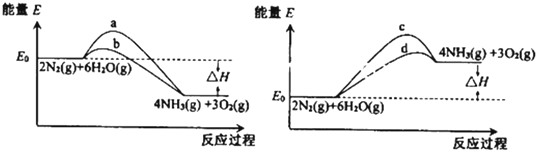
(3)该反应能否自发进行 .
Ⅲ.目前工业合成氨的原理为N2(g)+3H2(g)?2NH3(g)△H═-93.0kJ/mol
(1)结合Ⅱ中的数据,则2H2(g)+O2(g)═2H2O(g)△H═ .
(2)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率a1= .
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为a2,当a1+a2=1时,则起始时NH3的物质的量n(NH3)= mol.
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验电解法合成氨,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2
| SCY陶瓷 |
| 一定条件 |
Ⅱ.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应:
2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H═+1266kJ/mol
(1)上述反应的平衡常数表达式为
(2)若上述反应在有催化剂的情况下发生,则如图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是

(3)该反应能否自发进行
Ⅲ.目前工业合成氨的原理为N2(g)+3H2(g)?2NH3(g)△H═-93.0kJ/mol
(1)结合Ⅱ中的数据,则2H2(g)+O2(g)═2H2O(g)△H═
(2)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率a1=
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为a2,当a1+a2=1时,则起始时NH3的物质的量n(NH3)=
考点:化学平衡的计算,反应热和焓变,常见化学电源的种类及其工作原理,化学平衡建立的过程
专题:基本概念与基本理论
分析:Ⅰ、依据电解原理分析,阳极是失电子发生氧化反应,阴极是得到电子发生还原反应,结合化学反应的方程式中元素化合价变化判断得到,电极名称和电极反应;
Ⅱ、(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能;
(3)依据反应自发进行的判断依据和反应特征分析;
Ⅲ、(1)依据热化学方程式和盖斯定律计算所需让化学方程式;
(2)①根据差量法求出参加反应的H2,然后求出转化率;
②根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol.
Ⅱ、(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能;
(3)依据反应自发进行的判断依据和反应特征分析;
Ⅲ、(1)依据热化学方程式和盖斯定律计算所需让化学方程式;
(2)①根据差量法求出参加反应的H2,然后求出转化率;
②根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol.
解答:
解:Ⅰ、电解池的阳极发生氧化反应,阴极发生还原反应,所以氢气不断通入阳极;阴极氮气得到电子结合氢离子反应生成氨气,电极反应为:N2+6H++6e-=2NH3,
故答案为:阳;N2+6H++6e-=2NH3;
Ⅱ、(1)2N2(g)+6H2O(g)?4NH3(g)+3O2(g),平衡常数K=
,
故答案为:
;
(2)反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能,因此应该选d,
故答案为:d;
(3)2N2(g)+6H2O(g)?4NH3(g)+3O2(g),反应是气体体积减小的吸热反应,△H>0,△S<0,则△H-T△S>0,反应不能自发进行;
故答案为:不能;
Ⅲ、(1)①2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H═+1266kJ/mol,
②N2(g)+3H2(g)?2NH3(g)△H═-93.0kJ/mol
依据盖斯定律计算(②×2-①)÷3得到:2H2(g)+O2(g)═2H2O(g)△H═-484.0KJ/mol;
故答案为:-484.0KJ/mol;
(2)①N2(g)+3H2(g)?2NH3(g)△n
1 3 2 2
1.8mol (4-2.8)mol
H2的转化率α1为转化率为
×100%=60%;
故答案为:60%;
②根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol,所以起始时NH3的物质的量2mol,故答案为:2.
故答案为:阳;N2+6H++6e-=2NH3;
Ⅱ、(1)2N2(g)+6H2O(g)?4NH3(g)+3O2(g),平衡常数K=
| c3(O2)c4(NH3) |
| c2(N2)c6(H2O) |
故答案为:
| c3(O2)c4(NH3) |
| c2(N2)c6(H2O) |
(2)反应是吸热反应,应从c、d曲线中找答案,使用催化剂可以降低反应的活化能,因此应该选d,
故答案为:d;
(3)2N2(g)+6H2O(g)?4NH3(g)+3O2(g),反应是气体体积减小的吸热反应,△H>0,△S<0,则△H-T△S>0,反应不能自发进行;
故答案为:不能;
Ⅲ、(1)①2N2(g)+6H2O(g)?4NH3(g)+3O2(g)△H═+1266kJ/mol,
②N2(g)+3H2(g)?2NH3(g)△H═-93.0kJ/mol
依据盖斯定律计算(②×2-①)÷3得到:2H2(g)+O2(g)═2H2O(g)△H═-484.0KJ/mol;
故答案为:-484.0KJ/mol;
(2)①N2(g)+3H2(g)?2NH3(g)△n
1 3 2 2
1.8mol (4-2.8)mol
H2的转化率α1为转化率为
| 1.8mol |
| 3mol |
故答案为:60%;
②根据题意可以判断出是从正逆两个方向建立的平衡,由此推断出起始时NH3的物质的量为2mol,所以起始时NH3的物质的量2mol,故答案为:2.
点评:本题以合成氨为载体来考查化学反应原理中的电化学、化学反应的热效应、化学反应的限度(平衡态的建立、转化率、化学平衡与反应热),难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| ② | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| ③ | 苯(硝基苯) | 蒸馏 | |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A、①② | B、①③ | C、只有③ | D、③④ |
下列关于氯化铁溶液与氢氧化铁胶体的叙述不正确的是( )
| A、分散质颗粒都可以透过滤纸 |
| B、它们都是较稳定的分散系 |
| C、用一束平行光照到溶液里时,从侧面可以看到氢氧化铁胶体中有一束光亮的“通路” |
| D、在氯化铁溶液滴加氢氧化钠溶液可制的氢氧化铁胶体 |