题目内容
氮氧化物进入大气后会对大气造成很大程度的污染,因此必须对含有氮氧化物的废气进行处理.
(1)用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH═2NaNO2+H2O ①
2NO2+2NaOH═NaNO2+NaNO3+H2O ②
标出反应①中电子转移的方向和数目.在反应①中,当生成13.8g氧化产物时,吸收的气体的体积在标况下为 L,转移的电子的物质的量为 .在反应②中,氧化剂和还原剂的物质的量之比为 .
(2)汽车尾气中含有NO和CO,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气基本无污染的气体,该反应的化学方程式为 .
(3)氨气亦可以用来处理氮氧化物.例如氨气与二氧化氮发生如下反应:
□NO2+□NH3-□N2+□H2O
配平该氧化还原反应方程式.
(1)用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH═2NaNO2+H2O ①
2NO2+2NaOH═NaNO2+NaNO3+H2O ②
标出反应①中电子转移的方向和数目.在反应①中,当生成13.8g氧化产物时,吸收的气体的体积在标况下为
(2)汽车尾气中含有NO和CO,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气基本无污染的气体,该反应的化学方程式为
(3)氨气亦可以用来处理氮氧化物.例如氨气与二氧化氮发生如下反应:
□NO2+□NH3-□N2+□H2O
配平该氧化还原反应方程式.
考点:氧化还原反应的计算,氧化还原反应的电子转移数目计算,氧化还原反应方程式的配平,氮的氧化物的性质及其对环境的影响
专题:氧化还原反应专题,氮族元素
分析:(1)反应NO2+NO+2NaOH═2NaNO2+H2O中,N元素化合价分别由+4价、+2价变化为+3价,NO2为氧化剂,NO为还原剂,NaNO2既是氧化产物,也是还原产物;
(2)NO和CO在催化作用下反应生成二氧化碳和氮气;
(3)反应中N元素化合价分别由+4价、-1价变化为0价,以此配平方程式.
(2)NO和CO在催化作用下反应生成二氧化碳和氮气;
(3)反应中N元素化合价分别由+4价、-1价变化为0价,以此配平方程式.
解答:
解:(1)反应NO2+NO+2NaOH═2NaNO2+H2O中,N元素化合价分别由+4价、+2价变化为+3价,转移的电子方向和数目可表示为 ,
,
n(NaNO2)=
=0.2mol,当生成13.8g氧化产物时,NaNO2既是氧化产物,也是还原产物,应同时生成13.8g氧化产物,则共生成0.4mol NaNO2,共需要0.4mol气体,体积为0.4mol×22.4L/mol=8.96L,转移0.4mol电子,在反应2NO2+2NaOH═NaNO2+NaNO3+H2O中,N元素化合价由+4价分别变化为+5价、+3价,NO2既是氧化剂也是还原剂,氧化剂和还原剂物质的量之比为1:1,
故答案为: ;8.96;0.4mol;1:1;
;8.96;0.4mol;1:1;
(2)NO和CO在催化作用下反应生成二氧化碳和氮气,反应的方程式为2CO+2NO
N2+2CO2,故答案为:2CO+2NO
N2+2CO2;
(3)反应中N元素化合价分别由+4价、-1价变化为0价,反应的方程式为6NO2+8NH3=7N2+12H2O,
故答案为:6;8;7;12.
 ,
,n(NaNO2)=
| 13.8g |
| 69g/mol |
故答案为:
 ;8.96;0.4mol;1:1;
;8.96;0.4mol;1:1;(2)NO和CO在催化作用下反应生成二氧化碳和氮气,反应的方程式为2CO+2NO
| ||
| ||
(3)反应中N元素化合价分别由+4价、-1价变化为0价,反应的方程式为6NO2+8NH3=7N2+12H2O,
故答案为:6;8;7;12.
点评:本题考查较为综合,涉及氧化还原反应的计算,配平等知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该题,难度较大.

练习册系列答案
相关题目
下列分子中的所有碳原子不可能处在同一平面上的是( )


| A、②③ | B、①④⑤ |
| C、①②④ | D、①⑤ |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
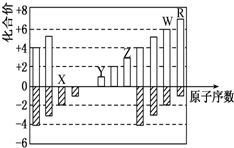

| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:R>W |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、2mol Z单质与足量Y的最高氧化物对应的水化物的溶液反应,有2mol H2O被还原 |
 石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照右图进行:
石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照右图进行: