题目内容
14.某氧化铁样品中含有少量的FeSO4杂质.某实验小组同学要测定其中铁元素的质量分数,设计了如下实验方案: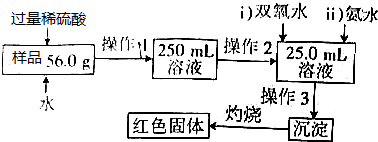
(1)写出加入过量稀硫酸发生反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O.
(2)用离子方程式加入双氧水的目的:2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作3的名称为过滤.
(4)证明加入氨水已经过量的操作是将试纸防止玻璃片,用玻璃棒蘸取溶液与pH试纸上,如试纸变蓝色,说明氨水过量.
(5)若坩埚的质量为42.6g,最终坩埚与加热后的固体的总质量为47.0g,则样品中铁元素的质量分数为55.0%.
分析 氧化铁样品中含有少量的杂质FeSO4,加入过量稀硫酸和水溶解反应得到硫酸铁和硫酸亚铁混合溶液,配制250.00ml溶液,用滴定管量取25ml溶液加入过氧化氢氧化亚铁离子,加入过量氨水沉淀铁离子,过滤洗涤得到氢氧化铁沉淀,灼烧得到红棕色固体为氧化铁,
(1)氧化铁与稀硫酸反应生成硫酸铁和水;
(2)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁;
(3)操作3用于分离固体和液体;
(4)如氨水过量,则溶液呈碱性,可用pH试纸测量;
(5)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×$\frac{112g}{160g/mol}$=(47.0g-42.6g)×$\frac{112g}{160g/mol}$=3.08g;
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{250}{25}$;
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{500}{50}$=30.8g,最后求样品中铁元素的质量分数.
解答 解:氧化铁样品中含有少量的杂质FeSO4,加入过量稀硫酸和水溶解反应得到硫酸铁和硫酸亚铁混合溶液,配制250.00ml溶液,用滴定管量取25ml溶液加入过氧化氢氧化亚铁离子,加入过量氨水沉淀铁离子,过滤洗涤得到氢氧化铁沉淀,灼烧得到红棕色固体为氧化铁
(1)氧化铁与稀硫酸反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)由于加双氧水的目的就是让+2价铁变为+3价,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)操作3用于分离固体和液体,为过滤操作,故答案为:过滤;
(4)如氨水过量,则溶液呈碱性,可用pH试纸测量,方法是将试纸防止玻璃片,用玻璃棒蘸取溶液与pH试纸上,如试纸变蓝色,说明氨水过量,也可滴加硫酸铁溶液,观察是否生成红褐色沉淀,
故答案为:将试纸防止玻璃片,用玻璃棒蘸取溶液与pH试纸上,如试纸变蓝色,说明氨水过量;
(5)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×$\frac{112g}{160g/mol}$=(47.0g-42.6g)×$\frac{112g}{160g/mol}$=3.08g;
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{250}{25}$;
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{500}{50}$=30.8g;
w(Fe)=$\frac{m(Fe)}{m(样品)}$×100%=$\frac{30.8g}{56.0g}$×100%=55.0%,
故答案为:55.0%.
点评 本题考查了物质组成的分析判断,为高频考点,侧重于学生的分析、实验和计算能力的考查,实验探究方法和实验过程分析,元素守恒的计算应用,误差分析和量具的精确度理解,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.| ② | |||
| ⑦ | ⑧ |
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素若是同一主族,任写一个符合条件的反应a的化学方程式:2Na+2H2O=2NaOH+H2↑或2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
单质乙与单质丙所含元素若是相邻主族,任写一个符合条件的反应a的化学方程式Mg+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+H2↑.
| A. | 可用分液漏斗分离乙醛与水的混合物 | |
| B. | 可用溴水一次全部鉴别出苯、乙醇、1-己烯、福尔马林和苯酚溶液 | |
| C. | 提纯苯甲酸(含有食盐固体)可采用溶解、过滤、蒸馏的方法 | |
| D. | 煤油、柴油、花生油、猪油的主要成分均为酯类 |
2CrO3+3C2H5OH+3H2SO4═Cr2(SO4)3+3CH3CHO+6H2O.
| A. | H2SO4 | B. | C2H5OH | C. | CrO3 | D. | Cr2(SO4)3 |
| A. | 油脂 | B. | 棉花 | C. | 氨基酸 | D. | 聚乙烯 |
| A. | 一氯甲烷的结构式:CH3Cl | B. | 苯的分子式: | ||
| C. | 葡萄糖的结构简式:C6H12O6 | D. | 丙烷分子的球棍模型: |
| A. | 肯定不能确定该物质的最简式 | B. | 肯定能确定该物质的最简式 | ||
| C. | 肯定不能确定该物质的分子式 | D. | 肯定不能确定该物质的结构式 |