题目内容
4.硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,可用于纸浆漂白作脱氯剂等.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室可通过如下反应:4SO2+2Na2S+Na2CO3═CO2+3Na2S2O3,其反应装置及所需试剂如图:实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O.

④再经过滤、洗涤、干燥,得到所需的产品.
(1)写出仪器A的名称蒸馏烧瓶,步骤④中洗涤时,为了减少产物的损失用的试剂可以是乙醇.
(2)NaOH溶液的作用是吸收SO2尾气,防止污染空气.
(3)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因S2O32-+2H+═S↓+SO2↑+H2O.
(4)最后得到的产品中可能含有Na2SO4杂质.请设计实验检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,反之,不含.
(5)测定产品纯度准确称取1.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L-1碘的标准溶液滴定.反应原理为2S2O32-+I2=S4O62-+2I-.三次平行实验消耗碘的标准溶液平均体积为16.00mL.产品的纯度为79.36%.
(6)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
分析 装置A为SO2的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以C为尾气吸收装置,吸收未反应的SO2,应该盛放碱性物质,一般采用NaOH溶液;
(1)仪器A的名称蒸馏烧瓶,Na2S2O3•5H2O易溶于水,难溶于乙醇,步骤④中洗涤时要减少该物质的溶解;
(2)NaOH溶液具有碱性,能吸收酸性气体;
(3)Na2S2O3在酸性条件下反应生成S、SO2和水;
(4)SO42-用盐酸酸化的BaCl2溶液检验;
(5)2 S2O32-+I2=S4O62-+2I-中硫代硫酸根离子和碘的关系式计算n( S2O32-),再根据m=nM计算其质量,硫代硫酸钠纯度=$\frac{硫代硫酸钠质量}{样品质量}×100%$;
(6)Na2S2O3在溶液中易被Cl2氧化成SO42-,氯气被还原生成氯离子,根据反应物和生成物书写离子方程式.
解答 解:装置A为SO2的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以C为尾气吸收装置,吸收未反应的SO2,应该盛放碱性物质,一般采用NaOH溶液;
(1)仪器A的名称蒸馏烧瓶,Na2S2O3•5H2O易溶于水,难溶于乙醇,步骤④中洗涤时要减少该物质的溶解,所以洗涤时用乙醇洗涤,故答案为:蒸馏烧瓶;乙醇;
(2)二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以C为尾气吸收装置,吸收未反应的SO2,故答案为:吸收SO2尾气,防止污染空气;
(3)Na2S2O3在酸性条件下反应生成S、SO2和水,离子方程式为S2O32-+2H+═S↓+SO2↑+H2O,故答案为:S2O32-+2H+═S↓+SO2↑+H2O;
(4)SO42-用盐酸酸化的BaCl2溶液检验,其检验方法为:取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,反之,不含,
故答案为:取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,反之,不含;
(5)2 S2O32-+I2=S4O62-+2I-中硫代硫酸根离子和碘的关系式得n( S2O32-)=0.1000mol/L×0.016L×2=0.0032mol,根据S原子守恒得n( S2O32-)=n(Na2S2O3•5H2O)=0.0032mol,m(Na2S2O3•5H2O)=nM=0.0032mol×248g/mol=0.7936g,硫代硫酸钠纯度=$\frac{硫代硫酸钠质量}{样品质量}×100%$=$\frac{0.7936g}{1.00g}$×100%=79.36%,
故答案为:79.36;
(6)Na2S2O3在溶液中易被Cl2氧化成SO42-,氯气被还原生成氯离子,根据反应物和生成物书写离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
点评 本题考查物质制备,为高频考点,涉及氧化还原反应、化学方程式的有关计算、离子检验、物质分离和提纯等知识点,综合性较强,明确基本原理、基本计算、基本性质是解本题关键,知道图中各个装置的作用及可能发生的反应,注意正确获取题给信息并灵活解答问题,题目难度中等.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案(1)卤族元素位于元素周期表的p区; 溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 2 形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
碘(填名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
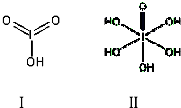
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)试分析 ClO2-中心氯原子的杂化类型sp3,试写出一个 ClO3-的等电子体Cl2O或OF2.
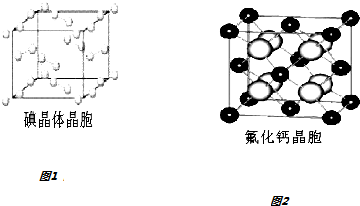
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.
| A. | Na+和Fe2+ | B. | Al3+和Na+ | C. | Fe2+和NH4+ | D. | Fe3+和Na+ |
| A. | 材料是为人类社会所需要并能用于制造有用器物的物质 | |
| B. | 人类使用和制造材料有悠久的历史,制造出的第一种材料是陶 | |
| C. | 体型结构的酚醛树脂制成的塑料,加工成型后,受热熔化后还可以制成其它形状的器物 | |
| D. | 高分子分离膜是具有传统高分子材料的机械性能,又具有特殊分离功能的功能高分子材料制成的薄膜 |
| A. | 1:1 | B. | 1:5 | C. | 1:9 | D. | 2:3 |

| A. | O2 | B. | Cl2 | C. | HCl | D. | N2 |