题目内容
10.用如图所示装置进行实验.能形成‘喷泉”的气体是( )
| A. | O2 | B. | Cl2 | C. | HCl | D. | N2 |
分析 由图可知,烧杯中为食盐水,极易溶于水的气体可形成喷泉实验,以此来解答.
解答 解:氧气、氯气、氮气均不能溶于饱和NaCl溶液,只有HCl可以,则挤压胶头滴管,形成压强差,可形成喷泉,
故选C.
点评 本题考查实验装置的综合运用及物质的性质,为高频考点,把握喷泉实验原理、物质的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.欲将蛋白质从水中析出而又不改变它的性质应加入( )
| A. | 甲醛溶液 | B. | 饱和Na2SO4溶液 | C. | CuSO4溶液 | D. | 浓硫酸 |
2.下列实验装置或实验方案能达到目的是( )
| A. | 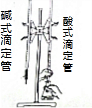 用HF标准溶液测定未知浓度的NaOH溶液 用HF标准溶液测定未知浓度的NaOH溶液 | |
| B. | 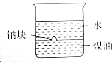 验证密度:ρ(水)<ρ(钠)<ρ(煤油) 验证密度:ρ(水)<ρ(钠)<ρ(煤油) | |
| C. | 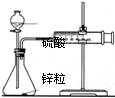 测定锌与硫酸反应的速率 测定锌与硫酸反应的速率 | |
| D. | 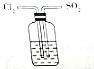 验证SO2和Cl2等物质的量混合增强漂白效果 验证SO2和Cl2等物质的量混合增强漂白效果 |
5.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为m g,则该混合物( )
| A. | 所含碳原子总数为$\frac{m{N}_{A}}{14}$ | |
| B. | 所含碳氢键数目为$\frac{3m{N}_{A}}{14}$ | |
| C. | 所含共用电子对数目为($\frac{m}{14}$+1)NA | |
| D. | 完全燃烧时消耗的O2一定是 $\frac{33.6m}{14}$L |
15.下列说法中,正确的是( )
| A. | 有机物和无机物都只能从有机体内提取 | |
| B. | 有机物都难溶于水,无机物都易溶于水 | |
| C. | 用化学方法能合成自然界已存在或不存在的有机物 | |
| D. | 有机物参与的反应速率一定比无机物参与的反应慢,且常伴有副反应 |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | pH=13的氢氧化钠溶液中所含Na+为0.1NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
19.关于Na2CO3和NaHCO3的叙述正确的是( )
| A. | NaHCO3和Na2CO3均能和BaCl2反应 | |
| B. | NaHCO3和Na2CO3都能加热分解,产生使石灰水变浑浊的气体 | |
| C. | 质量相同的NaHCO3和Na2CO3分别与足量稀盐酸反应,NaHCO3放出气体多 | |
| D. | 可以用澄清石灰水来鉴别Na2CO3NaHCO3溶液 |
20. 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )| 编号 | 1 | 2 | 3 | 4 |
| 气体M | H2S | NH3 | NO | H2 |
| 气体N | SO2 | HCl | O2 | Cl2 |
| A. | ①②③④ | B. | ②④①③ | C. | ④③①② | D. | ①④③② |
