题目内容
12.判断物质是否发生化学变化的依据是( )| A. | 放出热量 | B. | 产生气体 | ||
| C. | 物质状态发生变化 | D. | 有新的化学键形成 |
分析 根据化学变化的基本特征、化学反应实质分析,化学变化的特征是有新物质生成,化学反应实质为有旧键断裂,有新键生成,据此解答.
解答 解:化学变化的基本特征是有新物质生成,化学反应实质为有旧键断裂,有新键生成.
故选:D.
点评 本题考查了化学变化的判断依据,掌握化学变化的基本特征、化学反应的本质是正确解答本题的关键,易出现的误区是把变化的现象当成判断的依据,题目难度不大.

练习册系列答案
相关题目
2.草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中.下列有关判断不正确的是( )
| A. | 草酸的摩尔质量是90g/mol | |
| B. | 1mol草酸中含有6.02×1023个分子 | |
| C. | 45g草酸中含有1.204×1024个氧原子 | |
| D. | 1mol草酸在标准状况下的体积约为22.4L |
3.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 在常温常压下,17 g硫化氢所含质子数目为8 NA | |
| D. | 在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA |
7.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,11.2LNO2中所含的氧原子数为NA | |
| B. | 24gMg变为Mg2+时失去的电子数目为NA | |
| C. | 1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子效为2NA | |
| D. | 12.5mL16mol/L浓硫酸与6.5g锌共热,转移的电子数等于0.2NA |
17.下列有关物质分离,提纯的操作叙述错误的是( )
| A. | 进行蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| B. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 | |
| C. | 1一己醇的沸点比己烷的沸点高,1一己醇和己烷可通过蒸馏初步分离 | |
| D. | 提纯含有少量乙酸的乙酸乙酯;向含有少量乙酸的乙酸乙脂中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| B. | 室温下,1L pH=12的碳酸钠溶液中含有Na+的数目为0.02NA | |
| C. | 1L 0.1mol•L-1K2Cr2O7溶液中Cr2O72-的数目小于0.1NA | |
| D. | 电解精炼铜时,若阴极得到的电子数为2NA,则阳极质量一定减少64 g |
9. 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后向左侧烧杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(不考虑两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后向左侧烧杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(不考虑两球的浮力变化)( )
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后向左侧烧杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(不考虑两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后向左侧烧杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(不考虑两球的浮力变化)( )| A. | 杠杆为导体或绝缘体时,均为A端高B端低 | |
| B. | 杠杆为导体或绝缘体时,均为A端低B端高 | |
| C. | 当杠杆为导体时,A端高B端低 | |
| D. | 当杠杆为导体时,A端低B端高 |
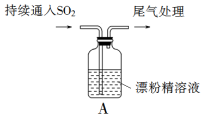 某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究:
某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究: