题目内容
7.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 常温常压下,11.2LNO2中所含的氧原子数为NA | |
| B. | 24gMg变为Mg2+时失去的电子数目为NA | |
| C. | 1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子效为2NA | |
| D. | 12.5mL16mol/L浓硫酸与6.5g锌共热,转移的电子数等于0.2NA |
分析 A.常温常压下Vm≠22.4L/mol;
B.镁失去电子生成二价镁离子;
C.偏铝酸钠溶液中偏铝酸钠和水都含有氧原子;
D.锌与浓硫酸和稀硫酸反应都生成硫酸锌,生成1mol锌转移2mol电子.
解答 解:A.常温常压下Vm≠22.4L/mol,Vm未知无法计算二氧化氮物质的量和氧原子个数,故A错误;
B.24gMg物质的量为$\frac{24g}{24g/mol}$=1mol,变为1molMg2+时失去的电子数目为2NA,故B错误;
C.偏铝酸钠溶液中偏铝酸钠和水都含有氧原子,所以.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数远远大于2NA,故C错误;
D.12.5mL16mol/L浓硫酸,硫酸的物质的量为0.0125mL×16mol/L=0.2mol,6.5g锌物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,依据反应事实Zn~2H2SO4(浓),Zn~H2SO4(稀),可知锌完全反应生成0.1mol锌离子,转移电子数等于0.2NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,熟悉浓硫酸的性质,掌握以物质的量为核心的计算公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列说法正确的一组是( )
①不溶于水的盐(CaC03、BaSO4等)部是弱电解质
②CO2和HCl都是化合物又是电解质
③0.5mol/L所有一元酸中氢离子浓度部是0.5mol/L
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
①不溶于水的盐(CaC03、BaSO4等)部是弱电解质
②CO2和HCl都是化合物又是电解质
③0.5mol/L所有一元酸中氢离子浓度部是0.5mol/L
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑤⑥ |
15.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
| A. | 分散质粒子直径与分散系种类: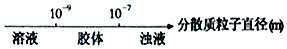 | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: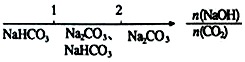 | |
| C. | AlCl3溶液中滴加NaOH溶液后铝的存在形式: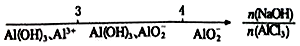 | |
| D. | Na与O2反应的产物: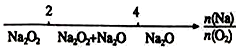 |
2.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 30g乙烷所含共用电子对数目为6NA | |
| B. | 标准状况下,22.4L已烷中共价键数目为6NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.1NA |
12.判断物质是否发生化学变化的依据是( )
| A. | 放出热量 | B. | 产生气体 | ||
| C. | 物质状态发生变化 | D. | 有新的化学键形成 |
19.下列各组液体混合物,能用分液漏斗分离的是( )
| A. | 1,2-二溴乙烷和四氯化碳 | B. | 己烷和高锰酸钾溶液 | ||
| C. | 氯仿和异戊烷 | D. | 酒精和水 |