题目内容
20.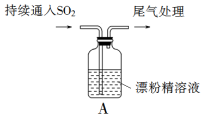 某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究:
某化学兴趣小组的同学们对SO2通入漂粉精溶液的反应进行实验探究:(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为1:1.
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgNO3溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?不合理(填“合理”或“不合理”),并说明理由因为白雾中可能含有少量Cl2和SO2,也容易产生沉淀.
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.该反应的离子方程式为ClO-+Cl-+2H+=H2O+Cl2↑.
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是CaSO4(填化学式);
②用离子方程式解释现象3中黄绿色褪去的原因SO2+Cl2+2H2O=SO42-+Cl-+4H+.
分析 (1)氯气与氢氧化钙反应为歧化反应;
(2)依据次氯酸根离子水解生成次氯酸和氢氧根离子解答;
(3)依据二氧化硫、氯气都能够与硝酸银溶液反应生成沉淀解答;
(4)次氯根离子与氯离子发生归中反应生成氯气;
(5)次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;二氧化硫具有还原性能与氯气发生氧化还原反应生成盐酸和硫酸,据此解答.
解答 解:(1)氯气与氢氧化钙反应为歧化反应,方程式:2Ca(OH)2 +2Cl2=Ca(ClO)2+CaCl2+2H2O,反应中一半氯气做氧化剂,一半氯气做还原剂,所以反应中氧化剂与还原剂的物质的量之比为1:1;
故答案为:1:1;
(2)次氯酸根离子水解生成次氯酸和氢氧根离子,氢氧根离子显碱性,次氯酸具有漂白性,所以看到试纸先变蓝后褪色;
故答案为:碱性、漂白性;
(3)A中产生的白雾可能够含有二氧化硫、氯气、氯化氢,三种气体都能与硝酸银反应生成沉淀,所以该结论不合理;
故答案为:不合理; 因为白雾中可能含有少量Cl2和SO2,也容易产生沉淀;
(4)次氯根离子与氯离子发生归中反应生成氯气,离子方程式:ClO-+Cl-+2H+=H2O+Cl2↑;
故答案为:ClO-+Cl-+2H+=H2O+Cl2↑;
(5)次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,硫酸根离子与钙离子反应生成亚硫酸钙沉淀,化学式CaSO4;
二氧化硫具有还原性能与氯气发生氧化还原反应生成盐酸和硫酸而使黄绿色褪色,离子方程式:SO2+Cl2+2H2O=SO42-+Cl-+4H+,
故答案为:CaSO4;SO2+Cl2+2H2O=SO42-+Cl-+4H+.
点评 本题为实验题,考查了二氧化硫、次氯酸盐的性质,明确相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
10.下列与胶体无关的是( )
| A. | 丁达尔效应 | B. | 明矾的净水作用 | ||
| C. | CuSO4溶液显蓝色 | D. | 分散质粒子直径1~100nm |
15.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
| A. | 分散质粒子直径与分散系种类: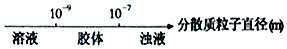 | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: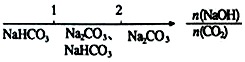 | |
| C. | AlCl3溶液中滴加NaOH溶液后铝的存在形式: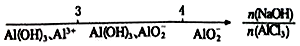 | |
| D. | Na与O2反应的产物: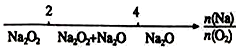 |
5.下列电离方程式书写正确的是( )
| A. | Na2SO4═2Na++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaOH═Na++O2-+H+ | D. | H2SO4═H22++SO42- |
12.判断物质是否发生化学变化的依据是( )
| A. | 放出热量 | B. | 产生气体 | ||
| C. | 物质状态发生变化 | D. | 有新的化学键形成 |
17.下列说法正确的是( )
| A. | 二氧化碳溶于水能部分电离,故二氧化碳属于电解质 | |
| B. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| C. | 氯化钠溶液在电流作用下完全电离成钠离子和氯离子 | |
| D. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 |