题目内容
3.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 在常温常压下,17 g硫化氢所含质子数目为8 NA | |
| D. | 在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA |
分析 A.过氧化氢分解为歧化反应;
B.蔗糖溶液中含有蔗糖分子、水分子;
C.依据n=$\frac{m}{M}$计算硫化氢物质的量,结合1个硫化氢含有18个质子解答;
D.根据标准状况下的气体摩尔体积计算出混合气体的物质的量及氧原子的数目.
解答 解:A.过氧化氢分解为歧化反应,2mol过氧化氢分解转移2mol电子,则0.2 mol过氧化氢完全分解转移的电子数目为0.2NA,故A错误;
B.蔗糖溶液中含有蔗糖分子、水分子,所以300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6 NA,故B错误;
C.在常温常压下,17 g硫化氢所含质子数目为$\frac{17g}{34g/mol}$×18×NA=9NA,故C错误;
D.在标准状况下,2.24L二氧化硫和氧气混合气体的物质的量是0.1mol,含有0.2mol氧原子,含氧原子数为0.2NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,掌握以物质的量为核心计算公式,熟悉相关物质的结构组成是解题关键,注意过氧化氢分解为歧化反应,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
13.下列有关FeBr2溶液的叙述错误的是(NA代表阿伏加德罗常数的数值)( )
| A. | 该溶液中Cu2+、NH4+、SO42-、Cl-可以大量共存 | |
| B. | 与硝酸酸化的AgNO3溶液反应有淡黄色沉淀生成并放出气体 | |
| C. | 向含有1 mol FeBr2的溶液中通入33.6 L Cl2,反应转移电子数目为3NA | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
14.设NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 1molNO和CO2的混合气体所含的原子数目为2NA | |
| B. | 在常温常压下,32g氧气所含的原子数目为NA | |
| C. | 在常温常压下,11.2L氮气所含的分子数目为0.5NA | |
| D. | 17g氨气所含电子数目为10NA |
18.下列说法正确的一组是( )
①不溶于水的盐(CaC03、BaSO4等)部是弱电解质
②CO2和HCl都是化合物又是电解质
③0.5mol/L所有一元酸中氢离子浓度部是0.5mol/L
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
①不溶于水的盐(CaC03、BaSO4等)部是弱电解质
②CO2和HCl都是化合物又是电解质
③0.5mol/L所有一元酸中氢离子浓度部是0.5mol/L
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑤⑥ |
15.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
| A. | 分散质粒子直径与分散系种类: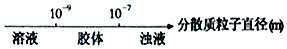 | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: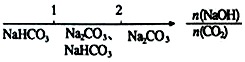 | |
| C. | AlCl3溶液中滴加NaOH溶液后铝的存在形式: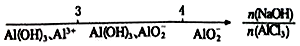 | |
| D. | Na与O2反应的产物: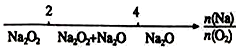 |
12.判断物质是否发生化学变化的依据是( )
| A. | 放出热量 | B. | 产生气体 | ||
| C. | 物质状态发生变化 | D. | 有新的化学键形成 |