题目内容
C2O42-和 是等电子体,C2O42-具有很强的还原性,它能是酸性KMnO4溶液褪色,Mn原子在元素周期表中的位置是 ,外围电子构型为 .
考点:原子核外电子排布,“等电子原理”的应用
专题:
分析:根据等电子体原理可知,C2O42-和 N2O4(分子)是等电子体,Mn元素处于周期表中第四周期ⅤⅡB族,其基态原子的外围电子排布式为3d54s2 ,然后写出外围电子排布图.
解答:
解:根据等电子体原理可知,C2O42-和 N2O4(分子)是等电子体,Mn元素处于周期表中第四周期ⅤⅡB族,其基态原子的外围电子排布式为3d54s2 ,外围电子排布图为: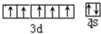 ;
;
故答案为:N2O4;第四周期ⅤⅡB; .
.
 ;
;故答案为:N2O4;第四周期ⅤⅡB;
 .
.
点评:本题考查“等电子原理”的应用,涉及周期表中的位置的确定、外围电子排布图、等电子体书写,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列分子中所有原子都满足最外层8电子结构的是( )
| A、PCl5 |
| B、HClO |
| C、PCl3 |
| D、BF3 |
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色. 铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成. 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
 (三聚氰胺)
(三聚氰胺) ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取 是电石的晶胞示意图,则一个晶胞中含有
是电石的晶胞示意图,则一个晶胞中含有