题目内容
13.把100g含NaCl 87.75%的粗食盐(杂质不与浓H2SO4反应)和98%的浓H2SO4(密度为1.84g/cm3)54.35mL混合后,在微热条件下发生NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑,可生成HCl气体多少克?分析 n(NaCl)=$\frac{100g×87.75%}{58.5g/mol}$=1.5mol,n(H2SO4)=0.05435L×$\frac{1000×1.84×98%}{98}$mol/L=1mol,结合反应及m=nM计算.
解答 解:n(NaCl)=$\frac{100g×87.75%}{58.5g/mol}$=1.5mol,n(H2SO4)=0.05435L×$\frac{1000×1.84×98%}{98}$mol/L=1mol,由NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑可知,NaCl过量,1molH2SO4反应生成1molHCl,则生成HCl的质量为1mol×36.5g/mol=36.5g,
答:生成HCl为36.5g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系、物质的量的相关计算公式为解答的关键,侧重分析与计算能力的考查,注意过量判断,题目难度不大.

练习册系列答案
相关题目
3.能产生“丁达尔效应”的是( )
| A. | 泥水 | B. | 淀粉溶液 | C. | 氯化铁溶液 | D. | 稀硫酸 |
1.下列除去杂质(括号内为杂质)的方法正确的是( )
①乙烷(乙烯)催化剂、加热条件下通入氢气
②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液
③苯(乙酸)用氢氧化钠溶液洗涤、分液
④乙醇(乙酸)加足量生石灰、蒸馏
⑤苯(苯酚)加入浓溴水、过滤.
①乙烷(乙烯)催化剂、加热条件下通入氢气
②乙酸乙酯(乙酸)用饱和碳酸钠溶液洗涤、分液
③苯(乙酸)用氢氧化钠溶液洗涤、分液
④乙醇(乙酸)加足量生石灰、蒸馏
⑤苯(苯酚)加入浓溴水、过滤.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②④⑤ |
8.下列有关化学键的叙述,正确的是( )
| A. | 离子化合物中一定只含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 仅含有共价键的化合物一定是共价化合物 | |
| D. | 由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
18.Na2O2、HClO、SO2、O3都具有漂白性.下列说法不正确的是( )
| A. | 过氧化钠、二氧化硫属于氧化物,而次氯酸属于弱酸,臭氧属于单质 | |
| B. | 它们都能使品红溶液褪色,但褪色原理不同;加热褪色的溶液都能变红 | |
| C. | 二氧化硫能与其他三种物质发生氧化还原反应,二氧化硫表现还原性 | |
| D. | 过氧化钠溶于水产生的气体与臭氧互为同素异形体,臭氧比氧气活泼 |
5.常温下,下列各组离子一定能大量共存的是( )
| A. | c(H+)=10-4 mol•L-1的溶液中:NH4+、K+,SO42-,NO3- | |
| B. | 无色溶液中:Na+,Cu2+,Cl-,NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液中:H+,K+,SO42-,I- | |
| D. | 饱和氯水中:Cl-,Na+,NO3-,SO32- |
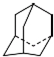 ,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )
,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )