题目内容
11.热化学方程式及盖斯定律应用较广.(1)4克硫粉完全燃烧时放出37kJ热量,该反应的热化学方程式是S(s)+O2(g)═SO2(g)△H=-296KJ/mol.
(2)已知反应:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2 (g)△H2
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3
则反应FeO(s)+CO(g)═Fe (s)+CO2(g)△H=$\frac{3△H1-△{H}_{2}-2△{H}_{3}}{6}$..
分析 (1)1molS单质的质量为32g,计算出32gS完全燃烧放热热量,然后写出该反应的化学方程式;
(2)根据盖斯定律,$\frac{①×3-②-③×2}{6}$可得:FeO(s)+CO(g)═Fe (s)+CO2(g),据此进行计算.
解答 解:(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ的热量,所以32g硫粉完全燃烧生成二氧化硫气体,放出296kJ的热量,则热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296KJ/mol,
故答案为:S(s)+O2(g)═SO2(g)△H=-296KJ/mol;
(2)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2 (g)△H2
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3
根据盖斯定律,$\frac{①×3-②-③×2}{6}$可得:FeO(s)+CO(g)═Fe (s)+CO2(g)△H=$\frac{3△H1-△{H}_{2}-2△{H}_{3}}{6}$kJ/mol,
故答案为:$\frac{3△H1-△{H}_{2}-2△{H}_{3}}{6}$.
点评 本题考查了热化学方程式书写与计算,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
12.根据下列事实所作的结论,正确的是( )
| 编号 | 事实 | 结论 |
| A | 不存在两种邻二甲苯 | 苯分子中碳碳键完全相同,而不是单双键交替结构 |
| B | 最简式相同的烃 | 要么是同系物要么是同分异构体 |
| C | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中,各元素的原子个数比一定相同 |
| D | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
10.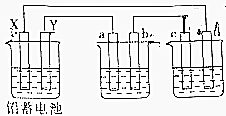 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( )| A. | 电路中通过1mol电子时,Y电极质量增加48g | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO${\;}_{4}^{2-}$(aq)+2e-=PbSO4(s)+2H2O(l) | |
| C. | c、d电极产生气体的物质的量之比为1:2 | |
| D. | X极为负极 |
6. 液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
 液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )| A. | 放电时,b极附近溶液pH减小 | |
| B. | a极的反应式为N2H4+4OH--4e-═N2↑+4H2O | |
| C. | 放电时,电子从b极经过负载流向a极 | |
| D. | OH-通过阴离子交换膜向a极移动 |
20.短周期主族元素X、Y、Z、W的原子序数依次增大,X是形成化合物种类最多的元素,Y原子最外层电子数是其内层电子数的2倍,W是地壳中含量最多的元素.下列叙述正确的是( )
| A. | Y与W可以组成YW32-、Y2W42- | |
| B. | 由X、Y、Z、W四种元素组成的既能与酸又能与碱反应的化合物,一定属于α-氨基酸 | |
| C. | 若化合物Y2X4W2能发生银镜反应,则该化合物一定是甲酸甲酯 | |
| D. | 混合物Y7X8、Y3 X8W3中X的质量分数约为8.7% |
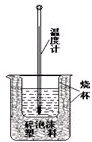 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: 氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题:
氮化镓是目前最热门的半导体材料,应用前景非常广阔.已有科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4,装置如图所示,回答下列问题: