题目内容
9.下列各组微粒中,互为等电子体的一组是( )| A. | CO、C2H2、N2 | |
| B. | SO2、NO${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
分析 根据原子数目与价电子数目相同的微粒为等电子体,据此结合选项判断.
解答 解:A.CO、N2都含有2个原子,C2H2含有4个原子,所以不是等电子体,故A错误;
B.SO2、NO2+、N3-、CNO-都含有3个原子,其价电子总数分别为:18、16、16、16,所以不是等电子体,故B错误;
C.CO32-、NO3-、BeCl2都含有4个原子,其价电子总数分别为:18、18、16,所以不是等电子体,故C错误;
D.SiF4、SiO44-、SO42-、PO43-都含有5个原子,其价电子总数分别为:32、32、32,32,所以是等电子体,故D正确;
故选D.
点评 本题考查了等电子体的判断,根据等电子体的概念来分析解答即可,难度不大.

练习册系列答案
相关题目
19.图是有关电化学的图示,完全正确的是( )
| A. |  稀H2SO4Cu-Zn原电池 | |
| B. |  CuSO4粗铜的精炼 | |
| C. | 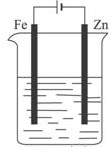 ZnCl2溶液铁片镀锌 | |
| D. | 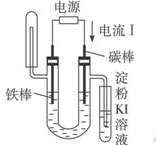 饱和氯化钠溶液验证NaCl溶液(含酚酞)电解产物 |
20.据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法不正确的是( )
| A. | 20Ne和22Ne互为同位素 | B. | 20Ne和22Ne的质子数为10 | ||
| C. | 20Ne和22Ne的电子数相同 | D. | 20Ne和22Ne的中子数相同 |
17.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,断开化学键吸收的能量大于形成化学键所放出的能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=QKJ/mol |
4.甲、乙两种物质的溶解度曲线如图所示.下列叙述正确的是( )


| A. | 将甲的溶液从t2℃降到t1℃,其溶质的质量分数一定减小 | |
| B. | t2℃时,甲、乙的饱和溶液各100g,其溶质的质量一定相等 | |
| C. | 当温度高于0℃而低于t1℃时,乙的溶解度比甲的溶解度大 | |
| D. | t2℃时,蒸发溶剂可使乙的饱和溶液析出晶体后变为不饱和溶液 |
14.巴豆酸的结构简式为CH3-CH═CH-COOH.现有①氯化氢;②溴水;③纯碱溶液;④2-丁醇;⑤酸性高锰酸钾溶液.试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①③④ | D. | ②④⑤ |
1.下列关于12C和13C说法正确的是( )
| A. | 两者互为同位素 | B. | 两者属于不同的元素 | ||
| C. | 两者属于同一种核素 | D. | 两者互为同素异形体 |
18.H2和CO2在催化剂作用下能缓慢地起反应生成CH3OH和H2O,对此反应,下列叙述中正确的是( )
| A. | 使用催化剂不能改变反应速率 | B. | 降低压强能使反应速率加快 | ||
| C. | 改变压强对反应速率没有影响 | D. | 升高温度能加快反应速率 |
19.X、Y、W、Q 四种元素在元素周期表中的位置如图,下列叙述错误的是( )
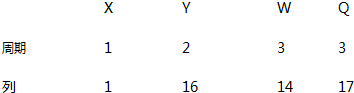
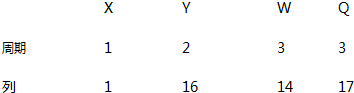
| A. | Y 的氢化物沸点高于 Q 的氢化物沸点 | |
| B. | 最高正价与最低负价之和为 0 的元素只有 W | |
| C. | 原子半径顺序为:r(W)>r(Q)>r(Y)>r(X) | |
| D. | X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32 |