题目内容
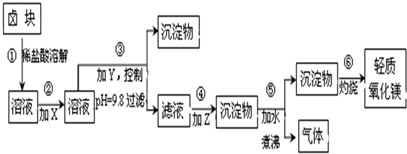
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧-钾氧化法”回收K2Cr2O7等物质.
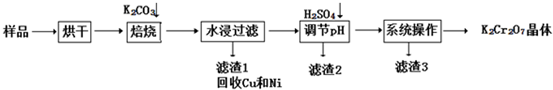
已知:①水浸后溶液中存在K2CrO4、KAlO2、K2ZnO2等物质;
②除去滤渣2后,溶液中存在如下反应:2CrO42-+2H+═Cr2O72-+H2O.
(1)水浸后的溶液呈 (填“酸”、“碱”、“中”)性.
(2)完成氧化焙烧过程中生成K2CrO4的化学方程式:
Cr(OH)3+ K2CO3+ K2CrO4+ CO2+ .
(3)滤渣2的主要成分有Zn(OH)2、 .
(4)“系列操作”中为:继续加入H2SO4, 冷却结晶,过滤.继续加入H2SO4目的是 .
(5)工业上还可以在水浸过滤后的K2CrO4溶液中加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式: .

已知:①水浸后溶液中存在K2CrO4、KAlO2、K2ZnO2等物质;
②除去滤渣2后,溶液中存在如下反应:2CrO42-+2H+═Cr2O72-+H2O.
(1)水浸后的溶液呈
(2)完成氧化焙烧过程中生成K2CrO4的化学方程式:
(3)滤渣2的主要成分有Zn(OH)2、
(4)“系列操作”中为:继续加入H2SO4,
(5)工业上还可以在水浸过滤后的K2CrO4溶液中加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式:
考点:物质分离和提纯的方法和基本操作综合应用,氧化还原反应方程式的配平
专题:实验设计题,氧化还原反应专题
分析:以含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质的电镀污泥为原料,烘干后加入碳酸钾和氧气高温灼烧发生反应4Cr(OH)3+4K2CO3+3O2
4K2CrO4+6H2O+4CO2,Al2O3+K2CO3
K2AlO3+CO2↑,ZnO++K2CO3
K2ZnO2+CO2↑,水浸后过滤得到滤渣CuO、NiO,滤液为K2CrO4,KAlO2、K2ZnO2等,调节溶液PH沉淀ZnO22-离子和偏铝酸根离子,过滤得到滤液K2CrO4,滤渣2的主要成分有Zn(OH)2、Al(OH)3,滤液K2CrO4加入硫酸酸化生成重铬酸钾溶液,通过提纯得到重铬酸钾;
(1)从盐类水解的角度解答;
(2)氧化焙烧过程中有氧气参加反应,结合质量守恒定律完成方程式;
(3)水浸后溶液中存在K2CrO4、KAlO2、K2ZnO2等物质,加入硫酸调节溶液的pH可得到Zn(OH)2、Al(OH)3沉淀;
(4)水浸后溶液中存在K2CrO4,加入硫酸发生CrO42-+2H+?Cr2O72-+H2O,从平衡移动的角度分析;
(5)生成铬的电极发生还原反应,CrO42-得到电子生成Cr.
| ||
| ||
| ||
(1)从盐类水解的角度解答;
(2)氧化焙烧过程中有氧气参加反应,结合质量守恒定律完成方程式;
(3)水浸后溶液中存在K2CrO4、KAlO2、K2ZnO2等物质,加入硫酸调节溶液的pH可得到Zn(OH)2、Al(OH)3沉淀;
(4)水浸后溶液中存在K2CrO4,加入硫酸发生CrO42-+2H+?Cr2O72-+H2O,从平衡移动的角度分析;
(5)生成铬的电极发生还原反应,CrO42-得到电子生成Cr.
解答:
解:(1)水浸后溶液中存在K2CrO4、KAlO2、K2ZnO2等都为强碱弱酸盐,水解呈碱性,
故答案为:碱;
(2)氧化焙烧过程中有氧气参加反应,根据质量守恒可知还应生成水,反应的方程式为4Cr(OH)3+4K2CO3+3O2=4K2CrO4+4CO2+6H2O,
故答案为:4Cr(OH)3+4K2CO3+3O2=4K2CrO4+4CO2+6H2O;
(3)Zn(OH)2、Al(OH)3具有两性,水浸后溶液中存在K2CrO4、KAlO2、K2ZnO2等物质,加入硫酸调节溶液的pH可得到Zn(OH)2、Al(OH)3沉淀,
故答案为:Al(OH)3;
(4)水浸后溶液中存在K2CrO4,加入硫酸发生CrO42-+2H+?Cr2O72-+H2O,加入硫酸可使平衡向正反应方向移动,将溶液蒸发浓缩、冷却结晶可得到晶体,
故答案为:蒸发浓缩;促进平衡CrO42-+2H+?Cr2O72-+H2O向正反应方向移动,尽可能生成更多溶解度更大的K2Cr2O7;
(5)生成铬的电极发生还原反应,CrO42-得到电子生成Cr,反应的电解方程式为CrO42-+8H++6e-=Cr+4H2O,
故答案为:CrO42-+8H++6e-=Cr+4H2O.
故答案为:碱;
(2)氧化焙烧过程中有氧气参加反应,根据质量守恒可知还应生成水,反应的方程式为4Cr(OH)3+4K2CO3+3O2=4K2CrO4+4CO2+6H2O,
故答案为:4Cr(OH)3+4K2CO3+3O2=4K2CrO4+4CO2+6H2O;
(3)Zn(OH)2、Al(OH)3具有两性,水浸后溶液中存在K2CrO4、KAlO2、K2ZnO2等物质,加入硫酸调节溶液的pH可得到Zn(OH)2、Al(OH)3沉淀,
故答案为:Al(OH)3;
(4)水浸后溶液中存在K2CrO4,加入硫酸发生CrO42-+2H+?Cr2O72-+H2O,加入硫酸可使平衡向正反应方向移动,将溶液蒸发浓缩、冷却结晶可得到晶体,
故答案为:蒸发浓缩;促进平衡CrO42-+2H+?Cr2O72-+H2O向正反应方向移动,尽可能生成更多溶解度更大的K2Cr2O7;
(5)生成铬的电极发生还原反应,CrO42-得到电子生成Cr,反应的电解方程式为CrO42-+8H++6e-=Cr+4H2O,
故答案为:CrO42-+8H++6e-=Cr+4H2O.
点评:本题考查物质的分离提纯的综合实验设计,侧重于分离、提纯方案的设计和操作,题目难度中等,注意把握题给信息和电极方程式的书写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关概念间关系的说法正确的是( )
| A、碱性氧化物一定是金属氧化物 |
| B、金属氧化物一定是碱性氧化物 |
| C、酸性氧化物一定是非金属氧化物 |
| D、非金属氧化物一定是酸性氧化物 |
以下互为同位素的是( )
| A、金刚石与石墨 |
| B、D2与H2 |
| C、CO与CO2 |
| D、35Cl与37Cl |
某元素的原子最外层有两个电子,该元素( )
| A、是ⅡA族元素 |
| B、是金属元素 |
| C、是非金属元素 |
| D、无法确定属哪一类 |
下列叙述正确的是( )
| A、NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO3- |
| B、CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 |
| C、等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
某化学反应过程如图所示.由图得出的判断,错误的是( )


| A、铜是此反应的催化剂 |
| B、乙醇发生了还原反应 |
| C、生成物M的化学式为C2H4O |
| D、反应中有红黑交替变化的现象 |