题目内容
11.下列说法正确的是( )| A. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| B. | FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,加入KCSN溶液可能变成血红色 | |
| C. | 锌与浓硫酸不反应,与稀硫酸反应生成氢气 | |
| D. | 加入NaOH溶液,加热后产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+ |
分析 A.可能生成氢氧化镁等白色沉淀;
B.有固体剩余,则溶液中不存在铁离子;
C.锌与浓硫酸反应生成二氧化硫;
D.湿润的红色石蕊试纸变蓝,说明生成氨气.
解答 解:A.不一定为氢氧化铝沉淀,可能生成氢氧化镁等白色沉淀,应加入氢氧化钠溶液,观察沉淀是否溶解,故A错误;
B.有固体剩余,则溶液中不存在铁离子,加入KSCN,溶液不变为红色,故B错误;
C.浓硫酸具有强氧化性,锌与浓硫酸反应生成二氧化硫,故C错误;
D.湿润的红色石蕊试纸变蓝,说明生成氨气,则原溶液中含有铵根离子,故D正确.
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用字母编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
E.c(H+)•c(CH3COO-)/c(CH3COOH)
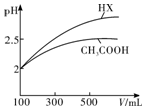
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(4)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(H+)+c(HCO3-);
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用字母编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
E.c(H+)•c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.

(4)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(H+)+c(HCO3-);
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
19.下列关于环境问题的说法不正确的是( )
| A. | 用甘蔗生产的乙醇燃料属于可再生能源,利用乙醇燃料不会产生温室气体 | |
| B. | 低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,可减少雾霾的发生 | |
| C. | 太阳能、风能和生物能源属于新能源 | |
| D. | 太阳能电池可将太阳能直接转化为电能 |
6.下列各物质投入水中,因促进水的电离而使溶液呈酸性的是( )
| A. | NaHSO4 | B. | Na2CO3 | C. | Al2(SO4)3 | D. | CH3COOH |
16.许多植物的花中含有色素,这些色素有的在酸性或碱性溶液中显示不同的颜色,故可作酸碱指示剂.现取三种花瓣,分别放在三个研钵中研磨,再依次加入酒精,搅拌,静置后得到花汁的酒精溶液.分别取少量上述所得的花汁的酒精溶液,用稀酸和稀碱液逐一检验,现象如下:
请回答:(1)以上所举的花中不能作酸碱指示剂的是万寿菊.
(2)经查资料得知,柑橘的近似pH为3.0~4.0.将大红花汁的酒精溶液滴入柑橘汁中,呈现的颜色应为橙色.
| 花的种类 | 花汁在酒精中的颜色 | 花汁在稀酸中的颜色 | 花汁在稀碱中的颜色 |
| 玫瑰 | 粉色 | 粉色 | 绿色 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 大红花 | 粉色 | 橙色 | 绿色 |
(2)经查资料得知,柑橘的近似pH为3.0~4.0.将大红花汁的酒精溶液滴入柑橘汁中,呈现的颜色应为橙色.
2.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:5,则Cl2与NaOH溶液反应时被氧化的氯原子与被还原的氯原子的物质的量之比为( )
| A. | 1:1 | B. | 5:1 | C. | 3:13 | D. | 4:15 |
19.根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )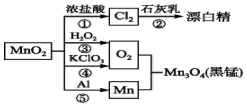

| A. | 反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应 | |
| B. | 反应⑤说明该条件下铝可用于制熔点较高的金属 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:4 |
 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.