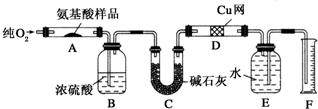
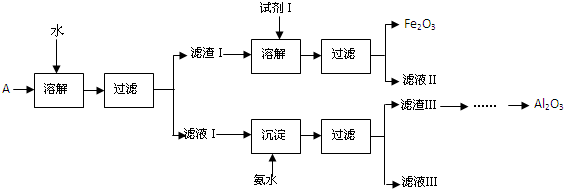
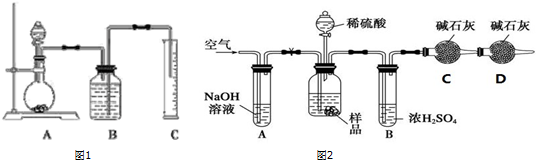
题目内容
1.以下性质的比较中,不正确的是( )| A. | 晶格能 NaCl<MgO | B. | 熔点:NH3<PH3 | ||
| C. | 离子半径:Na+<O2- | D. | 第一电离能:Mg>Al |
分析 A.电荷越大,离子半径越小,则晶格能越大;
B.氨气分子中含有氢键,大大增加了分子间作用力,导致氨气的沸点较高;
C.电子层相同时,核电荷数越大,离子半径越小;
D.金属性越强,第一电离能越小.
解答 解:A.离子的电荷越大、离子半径越小,晶格能越大,则晶格能大小为:NaCl<MgO,故A正确;
B.氨气分子中含有氢键,导致氨气的熔沸点较高,则沸点NH3>PH3,故B错误;
C.钠离子和氧离子具有相同电子层数,核电荷数越大,离子半径越小,则离子半径大小为:Na+<O2-,故C正确;
D.金属性Mg>Al,金属性越强,第一电离能越小,则第一电离能大小为:Mg>Al,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握影响晶格能的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )


| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 稀硫酸中有电子流动,方向是从b极到a极 | |
| D. | a极上发生了氧化反应 |
12.各周期包含的元素为( )
| A. | 2、8、18、32、72、98 | B. | 2、8、8、18、18、32 | C. | 2、8、8、18、32、32 | D. | 2、8、18、32、32、72 |
13.下列表示物质结构的化学用语或模型图正确的是( )
| A. | HClO的结构式:H-O-Cl | B. | H2O2的电子式: | ||
| C. | 质量数为14碳原子表示方法:14C | D. | 14C的原子结构示意图: |
10.下列说法正确的是( )
| A. | NaOH的摩尔质量为40 g | |
| B. | 1 mol O2的质量与它的相对分子质量相等 | |
| C. | 1 mol OH-的质量为17 g•mol-1 | |
| D. | 氦气的摩尔质量(单位g•mol-1)在数值上等于它的相对原子质量 |
11.最近媒体报道了一些化学物质,如爆炸力极强的N5、比黄金还贵重的18O2、太空中的甲醇气团等.下列说法正确的是( )
| A. | N5和N2是氮元素的两种同位素 | B. | 由N5变成N2是化学变化 | ||
| C. | 18O2和16O2是两种不同的核素 | D. | 甲醇属于离子化合物 |