题目内容
13.下列表示物质结构的化学用语或模型图正确的是( )| A. | HClO的结构式:H-O-Cl | B. | H2O2的电子式: | ||
| C. | 质量数为14碳原子表示方法:14C | D. | 14C的原子结构示意图: |
分析 A.次氯酸的中心原子为O原子,分子中含有1个H-O键和1个O-Cl键;
B.双氧水为共价化合物,分子中不存在阴阳离子;
C.元素符号的左上角为质量数,左下角为质子数;
D.碳原子的核电荷数=核外电子总数=6,最外层含有4个电子.
解答 解:A.HClO分子中含有1个H-O键和1个O-Cl键,其结构式为:H-O-Cl,故A正确;
B.双氧水为共价化合物,其正确的分子式为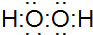 ,故B错误;
,故B错误;
C.碳原子的质子数为6,质量数为14碳原子表示方法为:146C,故C错误;
D.14C的核电荷数、核外电子总数为6,最外层含有4个电子,正确的原子结构示意图为: ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及原子结构示意图、电子式、结构式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
19.四种短周期元素A、B、C、D的原子序数之和为38.A的最高正价和最低负价代数和等于0,其阴离子和He原子具有相同的电子排布;C是地壳中含量最高的金属元素;D的气态氢化物和其最高价含氧酸都是强酸.下列说法正确的是( )
| A. | 通过电解熔融CD3可以制备C单质 | |
| B. | A和B可以形成BA3、B2A4等酸性化合物 | |
| C. | C的氢氧化物可以溶于B或D的最高价氧化物的水化物 | |
| D. | BA4BO3中只存在非金属元素,只存在共价键 |
4.某PH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4,在调节溶液pH值时,应选用的试剂是( )
| A. | NaOH | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
1.以下性质的比较中,不正确的是( )
| A. | 晶格能 NaCl<MgO | B. | 熔点:NH3<PH3 | ||
| C. | 离子半径:Na+<O2- | D. | 第一电离能:Mg>Al |
8.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L 1mo/L的FeCl3溶液中含有的Fe3+为1NA | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1mol铜与足量硫反应,转移的电子总数为NA | |
| D. | 18g D2O(重水)中所含电子个数为10 NA |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离出的c(H+)•c(OH-)═10-22的溶液:Mg2+、K+、Br-、HCO3- | |
| B. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、NO3- | |
| C. | 使pH试纸呈蓝色的溶液:Na+、AlO2-、SO42-、Cl- | |
| D. | 使甲基橙变红的溶液:Ca2+、NH4+、CH3COO-、Cl- |
5.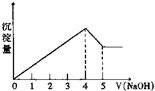 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )| A. | 2:1 | B. | 4:1 | C. | 1:2 | D. | 1:1 |
2.用NA表示阿伏伽德罗常数,下列叙述错误的是( )
| A. | 标准状况下,22.4LH2含有的分子数为NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L. |
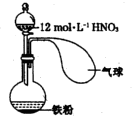 如图所示,向一定量的铁粉中加入一定体积12mol/L的浓硝酸并加热,待反应结束时,下列微粒在体系中一定大量存在的是( )
如图所示,向一定量的铁粉中加入一定体积12mol/L的浓硝酸并加热,待反应结束时,下列微粒在体系中一定大量存在的是( )