题目内容
11.有机物M是一种香料的合成原料,其结构简式如图所示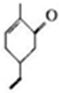 .下列有关M的说法正确的是( )
.下列有关M的说法正确的是( )| A. | 可以发生氧化反应 | B. | 分子式C9H10O | ||
| C. | 分子中所有原子都处子同一平面上 | D. | 不能使溴的四氯化碳溶液褪色 |
分析 A.该物质中含有碳碳双键和羰基,具有烯烃和酮的性质;
B.该分子中含有9个C原子、12个H原子和1个O原子;
C.该分子中具有甲基,甲基中所有原子不可能共平面;
D.该分子中具有碳碳双键,所有具有烯烃性质.
解答 解:A.该物质中含有碳碳双键和羰基,具有烯烃和酮的性质,碳碳双键能发生氧化反应,故A正确;
B.该分子中含有9个C原子、12个H原子和1个O原子,则分子式为C9H12O,故B错误;
C.该分子中具有甲基,甲基中所有原子不可能共平面,则该分子中所有原子不可能共平面,故C错误;
D.该分子中具有碳碳双键,所有具有烯烃性质,所以能与溴发生加成反应而使溴的四氯化碳溶液褪色,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析推断及知识迁移能力,涉及烯烃性质的考查,明确官能团及其性质关系是解本题关键,注意碳原子成键特点,易错选项是B.

练习册系列答案
相关题目
2.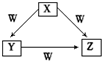 X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是( )
X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是( )
 X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是( )
X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是( )| X | Y | Z | W | |
| A | C | CO | CO2 | O2 |
| B | Na | Na2O | Na2O2 | O2 |
| C | AlCl3 | Al(OH)3 | NaAl(OH)4 | NaOH |
| D | Fe | FeCl2 | FeCl3 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
19.下列说法中不正确的是( )
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 反应物的总能量高于生成物的总能量时发生放热反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 一氧化碳在氧气中的燃烧是吸热反应 |
16.将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
①Ag2SO4(s)?Ag2O(s)+SO3(g)
②2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
①Ag2SO4(s)?Ag2O(s)+SO3(g)
②2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
| A. | SO3的分解率为20% | B. | 10分钟内ν(SO2)=0.01mol/(L•min) | ||
| C. | 容器内气体的密度为40g/L | D. | 此温度下反应①的平衡常数为4 |
3.工业上由钛铁矿(主要成分是FeTiO3钛酸亚铁)制备TiCl4.流程如图所示: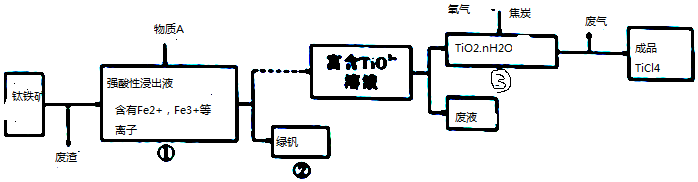
(1)FeTiO3中,Ti元素的化合价为+4.
(2)往①中加入的物质A是Fe.
(3)②中的绿矾带有棕黄色,原因可能是含有Fe3+;设计实验证明Fe3+杂质离子的存在取样,溶于水,向溶液中加入KSCN溶液,如果溶液变为血红色,证明含有Fe3+;
(4)写出③中TiO2和过量焦炭、氯气在高温下反应的化学方程式:TiO2+2C+Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)用金属Mg还原成品TiO4得到Mg、MgCl2和Ti的混合物,再真空蒸馏制备Ti. 依据下表,蒸馏温度略高于1412℃即可.
(6)依据绿色化学理念.该制备流程中存在明显的不足之处是三废没有处理.
(7)向含有Fe2+、Fe3+溶液加入适量KOH和油脂,在高速撞拌下得到磁流体材料KxFeO2.
①若x=l.请写出在酸性条件下KxFeO2溶液与足量KI溶液反应的离子方程式:8H++2FeO2-+2I-=2Fe2++I2+4H2O.
②磁流体材料KxFeO2在组成上可理解为aK2O•bFeO•cFe2O3,若x=1.3,则b:c=6:7.

(1)FeTiO3中,Ti元素的化合价为+4.
(2)往①中加入的物质A是Fe.
(3)②中的绿矾带有棕黄色,原因可能是含有Fe3+;设计实验证明Fe3+杂质离子的存在取样,溶于水,向溶液中加入KSCN溶液,如果溶液变为血红色,证明含有Fe3+;
(4)写出③中TiO2和过量焦炭、氯气在高温下反应的化学方程式:TiO2+2C+Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)用金属Mg还原成品TiO4得到Mg、MgCl2和Ti的混合物,再真空蒸馏制备Ti. 依据下表,蒸馏温度略高于1412℃即可.
| Mg | MgCl2 | Ti | |
| 熔点/℃ | 648.0 | 714 | 1667 |
| 沸点/℃ | 1090 | 1412 | 3287 |
(7)向含有Fe2+、Fe3+溶液加入适量KOH和油脂,在高速撞拌下得到磁流体材料KxFeO2.
①若x=l.请写出在酸性条件下KxFeO2溶液与足量KI溶液反应的离子方程式:8H++2FeO2-+2I-=2Fe2++I2+4H2O.
②磁流体材料KxFeO2在组成上可理解为aK2O•bFeO•cFe2O3,若x=1.3,则b:c=6:7.
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol Na与足量O2反应生成Na2O和Na2O2时,失去的电子数为2NA | |
| B. | 在密闭容器中,加入1mol N2和3mol H2,充分反应后生成NH3分子数为2NA | |
| C. | 足量铁在1mol Cl2中充分燃烧,转移的电子数目为2NA | |
| D. | 32gCu与S完全反应转移的电子数为NA |
16.下列说法正确的是( )
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化 | |
| C. | 化学反应中能量的变化一定都表现为热量的变化 | |
| D. | 氢氧化钡晶体和氯化铵晶体的反应属于放热反应 |
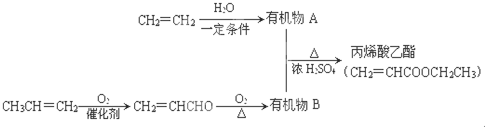
 ,丙烯酸乙酯分子中的含氧官能团名称是碳碳双键、酯基.
,丙烯酸乙酯分子中的含氧官能团名称是碳碳双键、酯基. .
.