题目内容
5.(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法
①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是2Al+2OH-+2H2O═2AlO+3H2↑(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b.
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为2Al+3H2O-6e-═Al2O3+6H+.电解后的铝材需氨洗的目的是中和表面的酸溶液.
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定.
(3)利用图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于N 处.若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极保护法(或牺牲阳极的阴极保护法).

分析 (1)①有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;酸碱可发生中和反应;
(2)用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定.
(3)根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法).
解答 解:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;电解后的铝材需要加氨水洗可中和表面的酸溶液,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;中和表面的酸溶液;
(2)电镀铜时用铜做阳极,阳极上铜被氧化,电解质溶液浓度不变,用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定,采用石墨无法补充Cu2+,
故答案为:补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定;
(3)金属的防护有牺牲阳极保法和外加电源阴极保护法,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法),故答案为:N;牺牲阳极保护法(或牺牲阳极的阴极保护法).
点评 本题考查金属的性质、盐类的水解、电解、电镀以及金属的腐蚀及防护知识,考查较为综合,做题时注意把握好Al、AlO2-、Al(OH)3等物质的性质,掌握电解、电镀等知识的原理,了解金属的防护措施,难度不大,但要注意知识的积累,厚积而薄发.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案| A. | 苯中少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却后溶液仍澄清透明 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以与NaCHO3反应放出CO2 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
| 离子方程式 | 评价 |
| A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液: H3PO3+3OH-=PO33-+3H2O | 正确 |
| B.在亚硫酸中加入少量的次氯酸钠溶液 H2SO3+ClO-=Cl-+2H++SO42- | 正确 |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++2HCO3-+2OH-=Mg CO3↓+CO32-+2H2O | 错误:生成物应是 Mg(OH)2和Na2CO3 |
| D.在过氧化钠中加入稀硫酸: 2Na2O2+4H+=4Na++2H2O+O2↑ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在H2O2参与的反应中,1 mol H2O2得到或失去的电子数一定是2NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
| A. | 第一电离能介于B、N之间的第二周期元素有1种 | |
| B. | 基态Fe原子的外围电子排布图为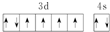 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.