题目内容
用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A、HCl |
| B、Na2SO4 |
| C、NaCl |
| D、NaOH |
考点:电解原理
专题:电化学专题
分析:用石墨作电极,电解下列物质的溶液,通电一段时间后溶液的pH不变,说明该电解质溶液中氢离子或氢氧根离子浓度不变,则溶液中的电解质不能是酸、碱、氢之后的含氧酸盐或氢之前的氯化物、溴化物或碘化物等.
解答:
解:A.电解氯化氢溶液时,阳极上氯离子放电、阴极上氢离子放电,导致溶液中氢离子浓度减小,溶液的pH增大,故A错误;
B.电解硫酸钠溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,相当于电解水,溶液中的溶质是强酸强碱盐,所以溶液pH不变,故B正确;
C.电解氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,导致溶液中氢氧根离子浓度增大,溶液的pH变大,故C错误;
D.电解NaOH溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,导致溶液中氢氧根离子浓度增大,溶液的pH增大,故D错误;
故选B.
B.电解硫酸钠溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,相当于电解水,溶液中的溶质是强酸强碱盐,所以溶液pH不变,故B正确;
C.电解氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,导致溶液中氢氧根离子浓度增大,溶液的pH变大,故C错误;
D.电解NaOH溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,导致溶液中氢氧根离子浓度增大,溶液的pH增大,故D错误;
故选B.
点评:本题考查了电解原理,明确离子放电顺序是解本题关键,根据各个电极上放电的离子结合溶液中氢离子或氢氧根离子浓度变化来分析解答,题目难度不大.

练习册系列答案
相关题目
下列关于实验操作的说法正确的是( )
| A、学生甲认为苯酚不慎沾在皮肤上时,根据苯酚能够与65℃以上的水任意比混溶,所以最好马上用65℃以上的水进行洗涤 |
| B、学生乙在做酸碱中和滴定实验时,将标准液盐酸溶液通过移液管移入锥形瓶,并滴加1-2滴酚酞作为指示剂,而待测液氢氧化钠溶液装入碱式滴定管进行滴定 |
| C、学生丙在称量某固体样品的质量时,托盘一端放入5克砝码,并将游码用镊子沿着刻度尺向盛样品的一端移动后,停在1.2克和1.3克偏右的某一处时,天平平衡,该生马上得到该样品的质量为6.3克 |
| D、学生丁在做中和热测定时,认为应用稀的含等物质的量的H+和OH-的溶液反应来进行测定 |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
根据如图转化关系推测下列说法中不正确的是( )

根据如图转化关系推测下列说法中不正确的是( )

| A、可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘 |
| B、在碘水中通入Cl2,发生反应的化学方程式为5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为:Cl2>I2>IO3- |
| D、途径Ⅲ中若消耗1 mol Cl2,反应中转移的电子数为2NA |
常温时,将500mL pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生.下列说法错误的是( )
| A、若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a) g CuCO3 |
| B、?b<a<7 |
| C、阳极电极反应:2H2O-4e-═O2↑+4H+ |
| D、整个过程中是阳极产生氧气,阴极析出铜单质 |
已知:①C(s)+O2(g)=2CO2(g);?△H=393.5kJ/mol
②2CO(g)+O2(g)═2CO2(g);?△H=-566kJ/mol;
③TiO2(s)+2C2(g)═TiCl4(g)+O2(g);?H=+141kJ/mol 则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H为( )
②2CO(g)+O2(g)═2CO2(g);?△H=-566kJ/mol;
③TiO2(s)+2C2(g)═TiCl4(g)+O2(g);?H=+141kJ/mol 则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H为( )
| A、-313.5kJ/mol |
| B、+313.5kJ/mol |
| C、-80.0kJ/mol |
| D、+80.0kJ/mol |

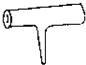 实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.
实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.