题目内容
以惰性电极电解CuSO4溶液,一段时间后取出电极,加入8gCuO后,溶液与电解前相同,则电解时电路流过的电子为 .
考点:电解原理
专题:电化学专题
分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 CuO后溶液与电解前相同,根据铜原子守恒结合一个铜转移2个电子进行计算.
解答:
解:8gCuO的物质的量=
=0.1mol,加入0.1 mol CuO后恰好恢复到电解前相同,则电解消耗了0.1mol铜离子,根据铜原子守恒结合一个铜转移2个电子,所以电解时电路流过的电子为0.1×2=0.2mol,
故答案为:0.2mol.
| 8g |
| 80g/mol |
故答案为:0.2mol.
点评:本题考查电解池的工作原理,先计算氧化铜的物质的量,再根据铜守恒结合一个铜转移2个电子进行计算,题目难度中等.

练习册系列答案
相关题目
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,以甲基橙为指示剂,下列有关说法正确的是( )
| A、用碱式滴定管向锥形瓶内注入10mL氢氧化钠溶液,若开始时滴定管尖嘴有气泡,则测定结果偏高 |
| B、边滴边振荡,直到溶液由橙色变成黄色且半分钟内不褪色为止 |
| C、接近滴定终点时,往锥形瓶加入少量蒸馏水,则测定结果偏高 |
| D、用酸式滴定管时,起始读数俯视,结束读数仰视,则测定结果偏高 |
对于可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列正确的是( )
A、平衡常数的表达式K=
| ||
| B、当v正(NH3):v正(NO)=1:1时,说明该反应已经达到平衡 | ||
| C、若平衡时两种反应物的转化率相等,则起始投入的n(NH3):n(O2)=5:4 | ||
| D、反应达到平衡后,恒容条件下,同倍数改变NH3和NO的量,c(O2)=可能不变 |
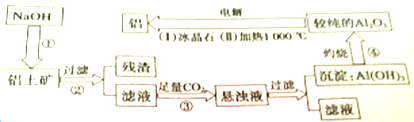

 写出①、②、③、④的方程式.
写出①、②、③、④的方程式.