题目内容
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,以甲基橙为指示剂,下列有关说法正确的是( )
| A、用碱式滴定管向锥形瓶内注入10mL氢氧化钠溶液,若开始时滴定管尖嘴有气泡,则测定结果偏高 |
| B、边滴边振荡,直到溶液由橙色变成黄色且半分钟内不褪色为止 |
| C、接近滴定终点时,往锥形瓶加入少量蒸馏水,则测定结果偏高 |
| D、用酸式滴定管时,起始读数俯视,结束读数仰视,则测定结果偏高 |
考点:中和滴定
专题:
分析:根据c(待测)=
分析误差.
| c(标准)×V(标准) |
| V(待测) |
解答:
解:A、用碱式滴定管向锥形瓶内注入10mL氢氧化钠溶液,若开始时滴定管尖嘴有气泡,待测液的物质的量偏小,导致消耗的标准液体积偏小,根据c(待测)=
可知,测定结果偏低,故A错误;
B、边滴边振荡,直到溶液由黄色变成橙色且半分钟内不褪色为止,故B错误;
C、接近滴定终点时,往锥形瓶加入少量蒸馏水,不影响待测液的物质的量,滴定过程中不影响消耗的标准液的体积,根据c(待测)=
可知,测定结果无影响,故C错误;
D、用酸式滴定管时,起始读数俯视,结束读数仰视,导致消耗的标准液体积偏大,根据c(待测)=
可知,测定结果偏高,故D正确;
故选D.
| c(标准)×V(标准) |
| V(待测) |
B、边滴边振荡,直到溶液由黄色变成橙色且半分钟内不褪色为止,故B错误;
C、接近滴定终点时,往锥形瓶加入少量蒸馏水,不影响待测液的物质的量,滴定过程中不影响消耗的标准液的体积,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
D、用酸式滴定管时,起始读数俯视,结束读数仰视,导致消耗的标准液体积偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故选D.
点评:本题考查了酸碱中和滴定的误差分析,试题基础性强,难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,注意明确误差分析的方法.

练习册系列答案
相关题目
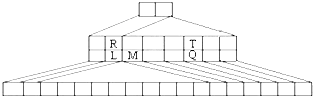 如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )
如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )| A、Q、T两元素的氢化物的稳定性为HnT<HnQ |
| B、L、R的单质与盐酸反应速率为R>L |
| C、M与T形成的化合物有两性 |
| D、L、Q形成的简单离子核外电子数相等 |
物质发生化学变化时,下列量在反应前后肯定不发生变化的是( )
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥质子总数.
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥质子总数.
| A、①②③⑤ | B、①②⑤⑥ |
| C、②③⑤⑥ | D、①④⑤ |
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、次氯酸 纯碱 硫酸钡 |
| B、硫酸 烧碱 小苏打 |
| C、盐酸 乙醇 氯化钠 |
| D、醋酸 漂白粉 石灰石 |
在下列反应中,Na2O2只表现出氧化性不表现出还原性的是( )
| A、Na2O2+SO2═Na2SO4 |
| B、2Na2O2+2CO2═2Na2CO3 +O2↑ |
| C、2Na2O2+2H2O═4NaOH+O2↑ |
| D、5Na2O2+MnO4-+16H+═10Na++2Mn2++5O2↑+8H2O |
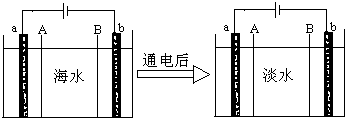 电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A、通电后,海水中阳离子往a电极处运动 |
| B、B膜是阴离子交换膜 |
| C、通电后,电子由b极经过溶液到达a极 |
| D、通电后,b电极上产生无色气体,溶液中少量白色沉淀 |
