题目内容
9. NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:实验Ⅰ.硫代硫酸钠晶体(Na2S2O3•5H2O)的制备:
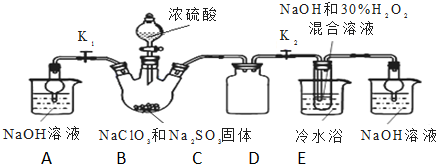
已知Na2S2O3•5H2O对热不稳定,超过48℃即开始丢失结晶水.现以Na2CO3和Na2S物质的量之比为2:1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3•5H2O.
(1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入C(填以下选择项的字母),并按如图安装好装置,进行反应.
A.稀盐酸 B.浓盐酸
C.70%的硫酸 D.稀硝酸
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊.反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热.如果通入SO2过量,发生的化学反应方程式为Na2S2O3+SO2+H2O=2NaHSO3+S↓;
(3)从上述生成物混合液中获得较高产率Na2S2O3•5H2O的歩骤为:
[反应混合液加活性炭脱色]$\stackrel{操作①}{→}$[滤液]$\stackrel{操作②}{→}$ $\stackrel{操作③}{→}$[粗晶体],为减少产品的损失,操作①为趁热过滤,其目的是趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质;操作②是蒸发浓缩,冷却结晶;操作③是抽滤、洗涤、干燥.
Ⅱ.产品纯度的检测:
(4)已知:Na2S2O3•5H2O的摩尔质量为248g/mol;2Na2S2O3+I2═2NaI+Na2S4O6.取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液v mL,则该样品纯度是$\frac{0.496v}{m}$%;
(5)滴定过程中可能造成实验结果偏低的是BD;
A.锥形瓶未用Na2S2O3溶液润洗 B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数
C.滴定终点时仰视读数 D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
Ⅲ.有毒废水的处理:
(6)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2mL 0.1mol/L 的NaCN溶液的试管中滴加2mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10mL 0.1mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式CN-+S2O32-=SCN-+SO32-.
分析 Ⅰ.(1)以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,根据反应原理可知,蒸馏烧瓶中加入的酸要使反应保持较快的反应速率,浓盐酸、硝酸都易挥发,而稀盐酸加入,反应速率较慢,据此答题;
(2)根据题意,Na2S2O3在酸性条件下会生成S,当溶液中pH接近或不小于7时,如果SO2通过量,会生成NaHSO3,据此书写化学方程式;
(3)从上述生成物混合液中获得较高产率Na2S2O3?5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3?5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,据此答题;
Ⅱ.产品纯度的检测
(4)vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,根据关系式2Na2 S2O3~I2计算 mg样品中n(Na2 S2O3),根据m=nM计算mg样品中Na2 S2O3•5H2O晶体的质量,据此据此纯度;
(5)A.锥形瓶未用Na2S2O3溶液润洗,对实验结果没影响;
B.用碘水滴定Na2S2O3溶液,锥形瓶中溶液变蓝后立刻停止滴定,进行读数,则加入的碘水的量不足;
C.滴定终点时仰视读数,会使读取的数值偏大;
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,则读出的标准液的体积偏小;
Ⅲ.(6)根据题中实验现象可知,生成的溶液能使 FeCl3溶液呈现血红色,说明有SCN-产生,根据电荷守恒和元素守恒可书写离子方程式.
解答 解:Ⅰ.(1)以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,根据反应原理可知,蒸馏烧瓶中加入的酸要使反应保持较快的反应速率,浓盐酸、硝酸都易挥发,而稀盐酸加入,反应速率较慢,所以用70%的硫酸,故选C;
(2)根据题意,Na2S2O3在酸性条件下会生成S,当溶液中pH接近或不小于7时,如果SO2通过量,会生成NaHSO3,反应的化学方程式为Na2S2O3+SO2+H2O=2NaHSO3+S↓,
故答案为:Na2S2O3+SO2+H2O=2NaHSO3+S↓;
(3)从上述生成物混合液中获得较高产率Na2S2O3?5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3?5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,所以操作①趁热过滤,其目的是:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是蒸发浓缩,冷却结晶,
故答案为:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质;蒸发浓缩,冷却结晶;
Ⅱ.产品纯度的检测
(4)vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,则:
2Na2 S2O3~~~~~~~I2
2 1
n(Na2 S2O3) v×10-5mol
所以n(Na2 S2O3)=2×v×10-5mol=2v×10-5mol
Na2 S2O3•5H2O晶体的质量为2v×10-5mol×248g/mol=496v×10-5g.
则该样品纯度为$\frac{496v×10{\;}^{-5}g}{mg}$×100%=$\frac{0.496v}{m}$%,
故答案为:$\frac{0.496v}{m}$%;
(5)A.锥形瓶未用Na2S2O3溶液润洗,对实验结果没影响,故A错误;
B.用碘水滴定Na2S2O3溶液,锥形瓶中溶液变蓝后立刻停止滴定,进行读数,则加入的碘水的量不足,会导致实验结果偏低,故B正确;
C.滴定终点时仰视读数,会使读取的数值偏大,则会使实验结果偏大,故C错误;
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,则读出的标准液的体积偏小,会导致实验结果偏低,故D正确,
故选BD;
Ⅲ.(6)由题中实验现象可知,生成的溶液能使 FeCl3溶液呈现血红色,说明有SCN-产生,根据电荷守恒和元素守恒可知共离子方程式为CN-+S2O32-=SCN-+SO32-,
故答案为:CN-+S2O32-=SCN-+SO32-.
点评 本题通过制取Na2S2O3•5H2O的实验操作,考查了物质制备方案的设计、基本实验操作、物质纯度的计算、滴定误差分析等,题目难度中等,明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向澄清石灰水中加入盐酸溶液:H++OH-═H2O | |
| C. | 向Ba(OH)2溶液中滴入过量的Na2SO 溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
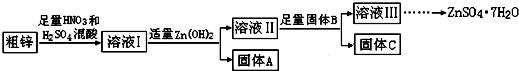
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是除去溶液Ⅱ中的Cu2+.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是13.42;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 | |
| D. | 物质的化学能可以在一定条件下转化为热能.电能为人类所利用 |
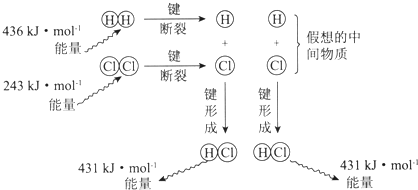
| A. | 该反应的反应热△H=-183kJ•mol-1 | |
| B. | 该反应生成液态HCl比生成气态HCl释放的能量少 | |
| C. | 氯气分子中的化学键比氢气分子中的化学键更稳定 | |
| D. | 1 mol HCl分子中的化学键形成时吸收431kJ的能量 |
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(填增大/减小/不变);
(2)关于该反应的下列说法中,正确的是A;
A.△H>0,△S>0B.△H>0,△S<0C.△H<0,△S>0D.△H<0,△S<0
(3)上述反应达到平衡后,将体系中的C (s)全部移走,平衡左移(向左移/向右移/不移动);
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
2C (s)+O2(g)=2CO (g)△H=-221.0kJ•mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为-787.0kJ/mol.
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |