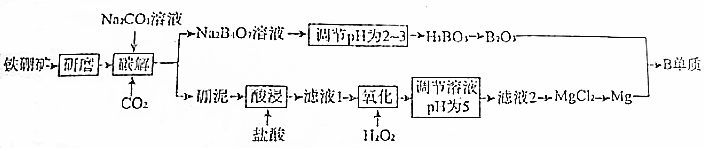
题目内容
2.下列有关溶液组成的描述合理的是( )| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ |
分析 A.弱碱性溶液中,四种离子之间不反应,可以共存;
B.该溶液呈酸性,硫离子与酸性溶液中的氢离子反应;
C.该溶液中存在大量氢离子或氢氧根离子,亚铁离子与氢氧根离子反应,酸性条件下硝酸根离子能够氧化亚铁离子;
D.漂白粉具有强氧化性,能够氧化亚铁离子.
解答 解:A.弱碱性溶液中,Na+、K+、Cl-、HCO3-离子之间不反应,可以共存,故A正确;
B.滴加石蕊呈红色的溶液呈酸性,S2-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故B错误;
C.与Al反应能放出H2的溶液中存在大量氢离子或氢氧根离子,Fe2+与氢氧根离子反应,酸性条件下Fe2+、K+、NO3-、之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.漂白粉具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故A错误;
故选A.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列说法不正确的是( )
| A. | 聚合物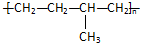 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| B. | 1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA | |
| C. | 乙醇、苯酚、乙酸都有羟基,但是羟基上的H活泼性不同,主要是基团之间相互影响造成的 | |
| D. | 等物质的量的乙炔和乙醛分别充分燃烧,所耗用氧气的量相同 |
14.在标有“20℃,25mL”的滴定管内装酸液至刻度“0”时,管内液体的体积( )
| A. | 大于25mL | B. | 等于25mL | C. | 小于25mL | D. | 无法判断 |
10. “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )| A. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| B. | 这种电池的工作原理可以认为是镁的吸氧腐蚀 | |
| C. | 活性炭电极上发生氧化反应 | |
| D. | 电池工作时实现了化学能向电能的转化 |
11. 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水,混合溶液中粒子浓度关系正确的是b(填序号).
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01mol/L C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义.25℃时,Na2CO3第一步水解反应的水解常数Kb=1.78×10-4mol/L.
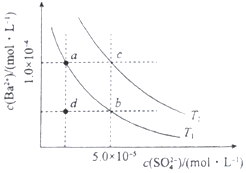
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大).
①T2> 25℃(填“>”、“<”或“=”)
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是bc(填序号).
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
③某课外活动小组为探究BaSO4的溶解度,分子将足量的BaSO4放入:
a.5mL水
b.20mL 0.5mol•L-1的Na2SO4溶液
c.40mL 0.2mol•L-1的Ba(OH)2溶液
d.40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.c>a>d>b B.c>a>b>d C.a>d>c>b D.a>c>d>b
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为0.11(或1.1×10-1).
 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K3=2.20×10-13 | - |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | - |
| NH3•H2O | NH3•H2O?OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42- | - | 1.1×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32- | - | 1×10-9 |
(1)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水,混合溶液中粒子浓度关系正确的是b(填序号).
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01mol/L C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义.25℃时,Na2CO3第一步水解反应的水解常数Kb=1.78×10-4mol/L.
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大).
①T2> 25℃(填“>”、“<”或“=”)
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是bc(填序号).
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
③某课外活动小组为探究BaSO4的溶解度,分子将足量的BaSO4放入:
a.5mL水
b.20mL 0.5mol•L-1的Na2SO4溶液
c.40mL 0.2mol•L-1的Ba(OH)2溶液
d.40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.c>a>d>b B.c>a>b>d C.a>d>c>b D.a>c>d>b
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为0.11(或1.1×10-1).
12.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水中,有无色气泡(H+) | |
| B. | 新制氯水呈黄绿色(Cl2) | |
| C. | 使蓝色石蕊试纸先变红后褪色(H+、Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |