题目内容
用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子).请回答:
(1)A元素是 .B元素是 (用元素符号表示).
(2)D是由两种元素组成的双原子分子,其分子式是 .
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其电子式是 .
(4)F是由两种元素组成的三原子分子,其分子式是 .
(5)H分子中含有8个原子,其结构式是 .
(6)G分子中含有4个原子,G与C2-在酸性条件下反应的离子方程式为 .
(1)A元素是
(2)D是由两种元素组成的双原子分子,其分子式是
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其电子式是
(4)F是由两种元素组成的三原子分子,其分子式是
(5)H分子中含有8个原子,其结构式是
(6)G分子中含有4个原子,G与C2-在酸性条件下反应的离子方程式为
考点:原子核外电子排布,无机物的推断
专题:原子组成与结构专题
分析:18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,结合题目所给条件,即可确定所需答案.
解答:
解:18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,
(1)含有18e-的A+、B-分别为K+、Cl-,所以A元素为K,B元素为Cl,故答案为:K;Cl;
(2)18e-微粒中由两种元素组成的双原子分子为HCl,故答案为:HCl;
(3)含18个电子的微粒中氧化能力最强的为F2,电子式为 ,故答案为:
,故答案为: ;
;
(4)由两种元素组成的三原子分子为H2S,故答案为:H2S;
(5)含有8个原子的18e-微粒为C2H6,结构式为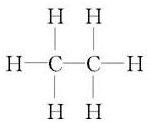 ,故答案为:
,故答案为: ;
;
(6)含有4个原子的18e-微粒中,分子式为H2O2或PH3,其中能与S2-的是H2O2,离子方程式为:2H++H2O2+S2-=S+2H2O,故答案为:2H++H2O2+S2-=S+2H2O.
(1)含有18e-的A+、B-分别为K+、Cl-,所以A元素为K,B元素为Cl,故答案为:K;Cl;
(2)18e-微粒中由两种元素组成的双原子分子为HCl,故答案为:HCl;
(3)含18个电子的微粒中氧化能力最强的为F2,电子式为
 ,故答案为:
,故答案为: ;
;(4)由两种元素组成的三原子分子为H2S,故答案为:H2S;
(5)含有8个原子的18e-微粒为C2H6,结构式为
 ,故答案为:
,故答案为: ;
;(6)含有4个原子的18e-微粒中,分子式为H2O2或PH3,其中能与S2-的是H2O2,离子方程式为:2H++H2O2+S2-=S+2H2O,故答案为:2H++H2O2+S2-=S+2H2O.
点评:本题考查18电子微粒的结构和性质,题目难度不大,本题注意常见10电子和18电子微粒,把握相关物质的性质.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
下列叙述中,正确的是( )
| A、1 mol O2 的质量为 32 g/mol |
| B、SO42-的摩尔质量是 96 g/mol |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、二氧化碳的摩尔质量是44 g |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、7.8g Na2O2含有的阴离子数目为0.2NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、25℃时,1.0L pH=9的CH3COONa溶液中H+和CH3COOH的总数目为10-5NA |
| D、己知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1 (Q>0),则将2NA 个SO2分子和NA 个O2,分子置于一密闭容器中充分反应后放出QkJ的 热量 |





 实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格: