题目内容
6.下列各组物质中,不经过化学变化就能够从海水中获得的是( )| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁 | D. | 烧碱、氢气 |
分析 根据海水中资源的获取方法,氯化钠含量比较高,可以通过晾晒的方法得到,而纯碱和其它元素的单质则需要化学反应才能得到.据此即可解答.
解答 解:A.氯化钠在海水中的浓度很大,用蒸馏等方法可以从海水中得到淡水,海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故A正确;
B.从海水中提炼溴和碘,是用氯气把其中的碘离子和溴离子氧化为碘单质和溴单质,是化学变化,故B错误;
C.要从海水中得到钠、镁,需要首先从海水中获得氯化钠和氯化镁,然后再去电解熔融状态的氯化钠和氯化镁,得钠和镁,是化学变化,故C错误;
D.电解饱和食盐水,得到烧碱、氢气和氯气,是化学变化,故D错误;
故选A.
点评 本题考查了从海水中获取化合物和单质的方法,熟悉物质的存在及物质的性质是解答本题的关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应不易控制,易还原产生Cu.
②已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-169kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ•mol-1.
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图1.
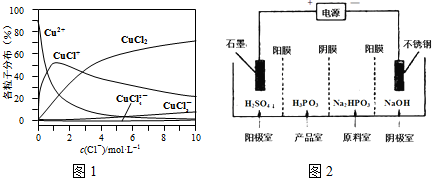
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl+═Cu2++Cl-(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
②电解Na2HPO3溶液可得到亚磷酸,装置如2图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
②已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-169kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ•mol-1.
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图1.

①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl+═Cu2++Cl-(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
②电解Na2HPO3溶液可得到亚磷酸,装置如2图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
1.下列物质能够导电又是强电解质的是( )
| A. | NaCl晶体 | B. | 液态氯化氢 | C. | 熔融的KNO3 | D. | NH3•H2O |
11.要使溶液中存在K+、Na+、H+、NO3-、SO42-、Cl-六种离子,则蒸馏水中至少溶解几种物质( )
| A. | 两种 | B. | 三种 | C. | 四种 | D. | 五种 |
 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答
 ,
, ,反应E-→F的化学方程式是:
,反应E-→F的化学方程式是: $→_{△}^{氢氧化钠/醇溶液}$
$→_{△}^{氢氧化钠/醇溶液}$ +HBr.
+HBr.